Căutare
Căutare
Toate procedurile
Analiza detaliată
Analiza detaliată
 Amigdalectomia este definită ca intervenția chirurgicală de scoatere a amigdalelor palatine. Amigdalectomia rămâne cea mai comună intervenție chirurgicală majoră în lume. Amigdalectomia are ca obiectiv potențial – când este indicată corect – să amelioreze calitatea vieții, și, în unele cazuri, intervenția chirurgicală poate fi salvatoare de viață.
Amigdalectomia este definită ca intervenția chirurgicală de scoatere a amigdalelor palatine. Amigdalectomia rămâne cea mai comună intervenție chirurgicală majoră în lume. Amigdalectomia are ca obiectiv potențial – când este indicată corect – să amelioreze calitatea vieții, și, în unele cazuri, intervenția chirurgicală poate fi salvatoare de viață.
Amigdalele palatine reprezintă prima linie de apărare a sistemului imun împotriva bacteriilor și virusurilor care pătrund în organism pe la nivelul cavității bucale. Această funcție le face să fie în mod particular vulnerabile la infecții și inflamații. Problema apare mai frecvent la copii, deoarece funcția de apărare a amigdalelor este mai activă înainte de pubertate.
Deși tehnicile de „îndepărtare“ sau extirpare a amigdalelor au evoluat în ultimii 2000 de ani – prima intervenție descrisă de Cornelius Celsus în primul secol înainte de era noastră – în prezent, medicii ORL-liști beneficiază de numeroase tehnici (electrocauterizarea, laser-ul și disecția cu grijă a amigdalelor în planul dintre capsula și musculatura din jur a faringelui). Deși tehnicile pentru extirparea amigdalelor s-au schimbat în timp, indicațiile chirurgicale nu s-au schimbat semnificativ, cu unele excepții. Deși etiologia infecțioasă constituie numărul 1 al indicației amigdalectomiei la începutul secolului XX-lea, în prezent, cele mai multe amigdalectomii se realizează pentru hiperplazia amigdaliană ce determină obstrucția căilor aeriene superioare.
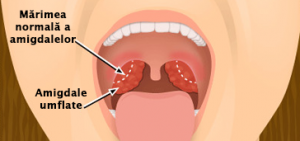
Amigdalele palatine sunt structuri pereche localizate pe peretele lateral al orofaringelui. În general, amigdalele rămân cu limitele lor în orofaringe; totuși, ele pot să fie mărite sau hipertrofiate, situație în care se extind spre nazofaringe sau, mai frecvent, inferior în regiunea hipofaringiană. Din punct de vedere clinic, țesutul amigdalian poate fi omis la examenul obiectiv dacă polul inferior al amigdalelor nu este vizualizat.
Amigdalele sunt situate în interiorul unei cavități (fose), între mușchiul palatoglos (anterior) și mușchiul palatofaringian (posterior) – pilierii amigdalieni, care pot fi vizualizați la examenul obiectiv. Amigdalele prezintă o capsulă, care este atașată la suprafața profundă a fasciei care acoperă musculatura faringelui. În cursul amigdalectomiei, mușchiul constrictor superior este expus și se consideră a fi responsabil de majoritatea durerilor postoperatorii, asociate cu această procedură chirurgicală. Senzația dureroasă a amigdalelor este realizată predominant de nervul glosofaringian și este suplimentată de otalgia care nu este neobișnuită, ca urmare a amigdalectomiei, sau în cursul unei infecții acute. Amigdalele nu au limfatice aferente și, în consecință, nu funcționează ca ganglionii limfatici.
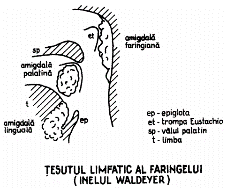
Din punct de vedere histologic, amigdalele au 10 – 30 de invaginații sau cripte, care sunt prevăzute cu un epiteliu scuamos specializat în procesarea de antigene. Antigenele, care sunt inhalate sau ingerate, vor trece în apropiere și vor fi preluate de amigdale. În acest mod, amigdalele acționează ca „radar imunologic“ și ca un „sit“ de prezentare a antigenelor. Lanțurile ganglionare limfatice jugulare și cervicale profunde sunt o sursă predominantă a drenajului limfatic al amigdalelor, situație care determină ca infecția amigdalelor să se asocieze cu prezența adenopatiilor cervicale. Amigdalele palatine alături de amigdalele tubare, amigdala faringiană și amigdala linguală fac parte din cercul limfatic a lui Waldeyer, care tapetează faringele.
Faringoamigdalita acută este inflamația acută a faringelui și amigdalelor palatine. Simptome ca durerile la nivelul cavității bucale, disfagia și febra împreună cu limfadenopatia cervicală sunt consecvente cu diagnosticul de faringoamigdalită acută, care constituie una dintre cele mai comune situații pentru copil de a fi prezentat la medicul de familie.
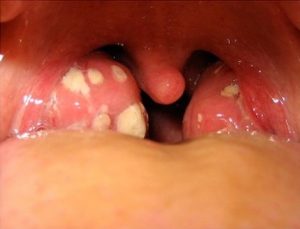 Simptomele debutează de obicei brusc și pot induce grețuri, vărsături, cefalee și dureri abdominale . Examenul clinic – obiectiv, frecvent, evidențiază amigdalele care sunt eritematoase și inflamate (angină eritematoasă), uneori cu prezența unui exsudat, depozite pultacee (angina pultacee), mai rar cu prezența de false membrane (angină pseudo – membranoasă) sau asociate cu ulcerații pe valul palatin (angină ulcero – necrotică). Diagnosticul este unul ușor, fiind pus de către medicul pediatru, ORL-ist sau de către medicul infecționist.
Simptomele debutează de obicei brusc și pot induce grețuri, vărsături, cefalee și dureri abdominale . Examenul clinic – obiectiv, frecvent, evidențiază amigdalele care sunt eritematoase și inflamate (angină eritematoasă), uneori cu prezența unui exsudat, depozite pultacee (angina pultacee), mai rar cu prezența de false membrane (angină pseudo – membranoasă) sau asociate cu ulcerații pe valul palatin (angină ulcero – necrotică). Diagnosticul este unul ușor, fiind pus de către medicul pediatru, ORL-ist sau de către medicul infecționist.
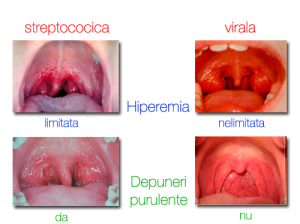
Se estimează că aproximativ 50% dintre cazurile de faringoamigdalită au o etiologie virală. Ca agenți patogeni sunt implicați rinovirusurile, virusul Epstein – Barr, adenovirusurile, virusurile parainfluenza tipurile A și B și alții. În 15 – 20% dintre cazuri, un patogen bacterian primar – cel mai comun fiind Streptococcus pyogenes (streptococul β-hemolitic de grupa A) – este constatat, dar și alți patogeni, ca Neisseria gonorrhoeae, pot fi, de asemenea, în cauză.
Cea mai comună cauza de faringită bacteriană la copii este streptococul β-hemolitic de grup A (Streptococcus pyogenes). Majoritatea faringitelor care sunt determinate de streptococul β-hemolitic de grup A sunt benigne și autolimitate, deși există un potențial pentru complicații supurative și nonsupurative. Astfel, diagnosticul și tratamentul este garantat când infecția cu streptococ β-hemolitic de grup A este suspectată.
Faringoamigdalita streptococică cu streptococul β-hemolitic de grup A este o boală foarte comună la adolescenți și copii, cu o incidență care crește în cursul lunilor de iarnă și primăvară. Este mai rar întâlnită la copiii sub vârsta de 3 ani. Transmiterea apare, în general, prin picături de saliva infectate împrăștiate în atmosferă; astfel, o serie de situații (strâns contact între persoane, cum ar fi militari, colegi de dormit sau familii mari) tinde să crească riscul.
Incubația bolii este, în general, de 2 – 5 zile și infectarea celor mai multe persoane se face precoce în cursul bolii. Tratamentul precoce cu antibiotice suprimă rapid infecția și scade riscul de transmitere a infecției în primele 24 de ore, permițând copiilor să se reîntoarcă la școală. Pacienții netratați se vor ameliora de obicei în 3 – 5 zile, cu excepția cazurilor la care au apărut complicații. Unele cazuri individuale, „purtătorii“, vor „adăposti“ asimptomatic bacteria, chiar urmând tratamentul, dar nu transmit boala la alte persoane.
Pentru că purtătorii vor avea culturi pozitive concordante, diferențiera infecției cu streptococ β-hemolitic de grup A de o faringită virală necesită un titru crescut de antistreptolizine O. Din cauza incertitudinii impuse de starea de purtător, American Academy of Pediatrics recomandă ca testarea pentru prezența streptococului β-hemolitic de grup A să nu fie efectuată la copiii cu semne și simptome foarte sugestive de infecție virală, ca tusea, coriza, conjunctivita, răgușeala, ulcerațiile orale și diareea.
Prezența unei colonizări streptococice, în particular în faringe, în absența simptomatologiei clinice și a răspunsului serologic imun definește portajul sau starea de purtător. Infecția este definită de existența răspunsului serologic specific. Prezența stării de purtător singură nu este o indicație clară de tratament, în special dacă pacientul este asimptomatic. Există unele circumstanțe în care tratamentul stării de purtător este de dorit, incluzând „purtătorii“ din familiile cu un istoric de reumatism articular acut, un istoric personal de glomerulonefrită, purtătorii din școli cu prezența epidemiei cu streptococ β-hemolitic de grup A, purtătorii care lucrează în spitale și cei care sunt din familii care au experimentat extensia bolii tip „ping – pong“. În cazurile refractare la tratament, trebuie luată în discuție amigdalectomia.
Complicațiile infecției cu streptococ β-hemolitic de grup A sunt clasificate în: non – supurative și supurative. Reumatismul articular acut (rheumatic fever – termenul de limba engleză) și glomerulonefrita acută poststreptococică cu complicațiile non – supurative majore apar în general după 1 – 3 săptămâni de la debutul infecției cu streptococ β-hemolitic de grup A. Incidența reumatismului articular acut a scăzut foarte mult în lume. În România, în ultimii 10 – 15 ani, reumatismul articular acut practic este aproape dispărut; acest lucru este legat de tratamentul cu Penicilină a faringoamigdalitei cu streptococ β-hemolitic de grup A.
Complicațiile supurative ale faringitei cu streptococ β-hemolitic de grup A includ abcesele periamigdaliene, abcesele retrofaringiene și adenitele sau abcesele cervicale. Datorită riscului complicațiilor ca urmare a infecției cu streptococ β-hemolitic de grup A netratată se impune un diagnostic precoce și o tratament antimicrobian adecvat. În general, semnele și simptomele cele mai compatibile cu o infecție veritabilă cu streptococ β-hemolitic de grup A sunt febra, exsudatul faringian și adenopatia.
Obținerea unei culturi din faringe este o metodă larg acceptată de identificare a infecției cu streptococ β-hemolitic de grup A. O cultură corectă este obținută prin tamponarea regiunii ambelor amigdale, criptelor amigdaliene și peretelui posterior al faringelui. Tamponul este apoi fixat pe o placă ce conține agar și 5% sânge de oaie ca și un disc de Bacitracină, care va inhiba creșterea streptococului β-hemolitic de grup A. O serie de tehnici de diagnostic s-au dezvoltat în ultimii 25 de ani, care se bazează pe atracția acidului nitric din antigenul grupului de carbohidrat A al bacteriei. Aceste teste alături de culturile de faringe au o specificitate de 85 – 90% și o sensibilitate de 60 – 90% .
De aceea, la un copil cu un test rapid pentru evidențierea streptococului și o suspiciune mare clinică de infecție cu streptococ β-hemolitic de grup A, trebuie efectuată o cultură clasică din faringe; pe de altă parte, un test rapid pozitiv nu necesită confirmarea prin cultură din faringe.
Testele definitive care determină prezența infecției cu streptococ β-hemolitic de grup A se bazează pe serologie. Streptolizina O și streptolizina S sunt două hemolizine produse de streptococul β-hemolitic de grup A, dar numai streptolizina O este antigenică la om. Titrul antistreptolizinei O (ASLO) va crește, în general, în decurs de o săptămână de la debutul infecției. Vârful titrului ASLO va fi atins la aproximativ 3 – 6 săptămâni după infecție, urmat de un declin foarte variabil al nivelurilor serice.
Deși un număr de medicamente sunt active împotriva streptococului β-hemolitic de grup A o cură de 10 zile cu penicilină V rămâne terapia de alegere a faringoamigdalitei cu streptococ β-hemolitic de grup A (după American Academy of Pediatrics).
Amoxicilina este, în mod obișnuit, un înlocuitor al penicilinei, deși nu există nici un avantaj microbiologic al acestei medicații. Benzatin – penicilina administrată intramuscular într-o doză unică la copii este incomfortabilă, este de asemenea eficientă și elimină complianța privind asocierea cu un regim dietetic pe cale orală. Cefalosporinele constituie o alternativă la terapia cu Penicilină și pot fi utilizate la pacienții alergici la Penicilină, deși există până la 15% neșansa unei alergii concomitente la cefalosporine. Clasic, a fost utilizată Eritromicina la pacienții cu alergie la Penicilină; totuși, noile generații de macrolide, cum sunt Azitromicina și Claritromicina, pot fi folosite. Există totuși o evidență recentă pentru rezistența streptococului β-hemolitic de grup A la antibioticele macrolide.
Clindamicina pe cale orală este eficientă împotriva streptococului β-hemolitic de grup A și, frecvent, este utilizată la purtătorii de streptococ β-hemolitic de grup A sau în caz de lipsă de răspuns la alte terapii. Sulfonamidele și tetraciclinele nu sunt recomandate în terapia infecției cu streptococ β-hemolitic de grup A.
Virusurile, improbabil a fi singurul factor etiologic în boala amigdaliană cronică, foarte probabil joacă un rol în dezvoltarea inflamației amigdaliene, obstrucției criptelor și, secundar, infecțiilor bacteriene. Penicilina nu este eficientă în eradicarea streptococului β-hemolitic de grup A din faringe la purtătorii cronici. De aceea, administrarea timp de 10 zile de Penicilină la un purtător cronic cu o presupusă infecție acută cu streptococ β-hemolitic de grup A va fi însoțită de un rezultat pozitiv al unei culturi din faringe efectuată post-terapeutic. O altă cauză posibilă a insuficienței penicilinei este activitatea inhibitorie a florei faringiene normale, cum ar fi Streptococcus salivarius. Această bacterie reprezintă o apărare naturală împotriva altor microorganisme potențial periculoase.
Copiii care devin purtători de streptococ β-hemolitic de grup A se pare că posedă o floră faringiană în mai mică măsură inhibitorie împotriva streptococului β-hemolitic de grup A decât la copiii care nu devin purtători cronici. După tratamentul cu Penicilină, exista o scădere cantitativă a florei faringiene și o scădere calitativă în acțiunea sa anti-streptococ β-hemolitic de grup A. În plus, bacteriile aerobe și anaerobe din flora faringiană, care produc β-lactamază pot face terapia cu Penicilină ineficientă.
Deși episoadele recurente de faringoamigdalită sunt acceptate, în general, ca indicații adecvate pentru amigdalectomie, nu există un consens dacă acești copii vor beneficia de acest procedeu terapeutic. Amigdalectomia a prezentat în domeniu perioade de entuziasm ca și de incertitudine cu privire la beneficiul general la copii. Există un declin natural în frecvența infecțiilor respiratorii superioare la copilul mare, dar mulți copii vor prezenta infecții recurente ale regiunii faringoamigdaliene. Dezvoltarea terapiei cu antibiotice a influențat abilitatea de a trata infecțiile faringoamigdaliene recurente și a prevenit o serie de sechele severe care pot să crească consecutiv acestora.
Studiile efectuate au căutat să răspundă la multele întrebări privind eficacitatea amigdalectomiei la copiii cu faringoamigdalite recurente. Unul dintre acestea a urmărit copiii sever afectați de faringoamigdalită. Pentru a fi introduși în studiu, copiii trebuiau să prezinte cel puțin trei episoade de amigdalită în fiecare din precedenții trei ani sau cinci episoade în fiecare din precedenții doi ani sau șapte episoade într-un an. În plus, unul sau mai multe din următoarele patru criterii trebuiau să caracterizeze fiecare episod: febră, adenopatii cervicale, exsudat amigdalian și culturi pozitive pentru streptococ β-hemolitic de grup A. Un tratament antibiotic adecvat trebuia administrat la cei suspecți sau dovediți a avea infecție cu streptococ β-hemolitic de grup A. Fiecare episod era necesar să fie confirmat prin examen ORL și descriere clinică în momentul apariției sale.
Spațiul periamigdalian este spațiul localizat între capsula amigdalei și musculatura peretelui faringian lateral; acesta este ocupat de țesut conjunctiv destins și mobil. Infecția în acest spațiu poate determina celulită periamigdaliană sau abces periamigdalian, care constituie o complicație a amigdalitei. Copiii cu abces periamigdalian prezintă aproape invariabil dureri severe în cavitatea bucală cu asocierea odinofagiei, disfagiei, otalgiei (reflexă) și o scădere în aportul oral de alimente și posibil și deshidratare. Unii dintre pacienți au tulburări de reglare a propriilor secreții faringiene și vor prezenta salivație abundentă, vâscoasă, care stagnează în faringe semn care trebuie luat în considerare datorită posibilității amenințătoare de obstrucție a căilor aeriene.
Vocea este frecvent „înăbușită“ și pacientul prezintă adesea trismus secundar imflamației în regiunea mușchilor pterigoidieni, făcând examinarea și tratamentul potențial dificile. Examenul ORL evidențiază asimetria amigdalelor, în general cu o tumefacție sau bombare vizibilă la nivelul abcesului. În mod clasic, amigdala afectată este împinsă medial și rotată inferior; cu toate acestea, aspectul amigdalei afectate poate fi „aproape“ normal. Uvula este edemațiată și, în general, deplasată de partea opusă a abcesului. Deși, de obicei, examenul clinic poate fi realizat, CT-ul al regiunii gâtului, cu substanță de contrast, administrată intravenos, demonstrează prezența unui flegmon sau mai frecvent, a unui abces „în inel“ mărit, la pacienții al căror diagnostic clinic nu este posibil sau la care există suspiciunea unui alt spațiu afectat al regiunii gâtului.
Starea căilor aeriene este de o importanță capitală în decizia de a recomanda pacientului un CT. Tehnica cu ultrasunete intraoral a fost raportată ca utilă în identificarea abcesului și în ghidarea puncționării sale cu un ac special pentru aspirația puroiului. Tratamentul trebuie să fie suportiv cu hidratare intravenoasă și controlul durerii. Un antibiotic cu activitate anti-Staphylococcus aureus sau anti-streptococ β-hemolitic de grup A trebuie ales.
Tipul de tratament inițial depinde de o serie de factori ce includ: vârsta copilului și nivelul său de cooperare, trecutul/istoricul medical al copilului, istoricul de amigdalite recurente, un istoric de abces periamigdalian în trecut și status-ul căilor aeriene. La un copil ce cooperează, chiar la vârsta de 6 ani, aspirația pe ac este cea mai puțin invazivă decizie și a fost demonstrată ca eficientă ca primă linie de tratament în 75% dintre cazuri.
Rolul amigdalectomiei în tratamentul abcesului periamigdalian este puțin controversat. Pe plan istoric, abcesul periamigdalian a fost considerat ca o indicație absolută pentru amigdalectomie. În prezent, se consideră că la un copil cu numai un episod de abces periamigdalian, amigdalectomia trebuie efectuată numai dacă există un istoric de amigdalită recurentă cu o frevență care justifică intervenția chirurgicală. La un copil cu abces periamigdalian și boală cronică amigdaliană care justifică amigdalectomia prin ea însăși, o amigdalectomie pe amigdale „inflamate“poate fi luată în considerare pentru reducerea numărului de proceduri invazive.
Dacă copilul prezintă o obstrucție semnificativă a căilor aeriene sau dacă abcesul periamigdalian se extinde la alte spații ale gâtului (spațiul faringian lateral) și metodele invazive au fost ineficiente, în această situație amigdalectomia „la cald“ poate fi efectuată. Recurența abcesului periamigdalian poate fi prezisă pe baza unui istoric de două sau trei episoade de amigdalită acută în anul anterior episodului inițial. Un astfel de istoric a fost evidențiat la 20 – 30% dintre pacienții cu abces periamigdalian; în aceste cazuri se recomandă a se lua în considerare amigdalectomia după managementul abcesului periamigdalian.
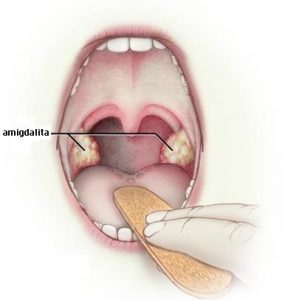 Deși insuficient de corect definită, mulți consideră durerea la nivelul „gâtului“ cu durată de cel puțin 3 luni, asociată cu inflamația amigdalelor a fi definiția amigdalitei cronice. Această entitate poate, de asemenea, să fie asociată cu halitoză și persistența adenopatiilor cervicale, sensibile la palpare. Alte entități clinice, ca refluxul gastroesofagian sau amigdalita linguală pot determina simptome similare și necesită a fi excluse.
Deși insuficient de corect definită, mulți consideră durerea la nivelul „gâtului“ cu durată de cel puțin 3 luni, asociată cu inflamația amigdalelor a fi definiția amigdalitei cronice. Această entitate poate, de asemenea, să fie asociată cu halitoză și persistența adenopatiilor cervicale, sensibile la palpare. Alte entități clinice, ca refluxul gastroesofagian sau amigdalita linguală pot determina simptome similare și necesită a fi excluse.
Examinarea clinică a amigdalelor la pacienții cu amigdalită cronică, frecvent, este neremarcabilă. Semne fruste – cum ar fi scăderea ca număr a criptelor sau o capsulă amigdaliană netedă și strălucitoare – pot fi o „cheie“ a acestei entități. Un tratament de 3 – 6 săptămâni cu un antibiotic eficient pe anaerobi și pe bacteriile producătoare de β-lactamază – cum ar fi Clindamicina sau Amoxicilină + Acid clavulanic – a fost raportată ca eficientă în tratamentul acestei boli.
Dacă în prezența unei amigdalite cronice, există o simptomatologie de obstrucție a căilor aeriene se indică amigdalectomie. În cazurile de amigdalită cronică fără infecții recurente sau obstrucție, medicul ORL trebuie să evalueze individual afecțiunea pacientului și să ia în discuție decizia privind o potențială amigdalectomie.
Virusul Epstein – Barr este un membru al familiei herpesviridae care poate determina amigdalită acută și hiperplazie adenoamigdaliană la copii. Virusul Epstein – Barr este un microorganism responsabil de toate cazurile de mononucleoză infecțioasă heterofil – pozitive și cele mai multe heterofil – negative. Infecția progresivă cu virusul Epstein-Barr este rezultatul dezordinilor imunității moștenite sau câștigate, care poate determina, de asemenea, limfoame și alte boli limfoproliferative. Între populațiile studiate pe glob, reactivitatea serologică a antigenelor virusului Epstein – Barr s-a demonstrat la 80 – 95% dintre adulți.
Infecția primară cu virusul Epstein – Barr apare în cursul celei de-a doua și a treia decade la adulții din țările dezvoltate și regiunile cu status socio-economic ridicat; copiii sunt mai afectați în țările în curs de dezvoltare și în regiunile cu status socio – economic scăzut. Când virusul este achiziționat la o vârstă mai mică, simptomele generale sunt mai puțin severe. Indivizii infectați transmit virusul Epstein – Barr pe calea salivei, în cursul sărutului sau altui contact apropiat.
Virusul Epstein – Barr infectează preferențial și transformă limfocitele B umane. Virusul pătrunde în celulă prin atașarea la receptorul desemnat pentru proteinele lanțului sau căii sistemului complement. Materialul său genetic este transportat prin vezicule la nucleu, unde există ca o plasmidă și menține o „stare de latență“ a replicării. O perioadă de incubație de 2 – 7 săptămâni urmează expunerii inițiale, în cursul căreia virusul Epstein – Barr induce o proliferare a celulelor B infectate. Acest proces care urmează este contracarat de un răspuns imun celular potent, caracterizat prin apariția de limfocite-T citotoxice „atipice“ în sânge. La gazdele imunocompromise răspunsul acestor limfocite-T este limitat și are ca rezultat o proliferare necontrolată a celulelor B care poate determina hiperplazia inelului Waldeyer și altor țesuturi limfoide, la fel ca într-o varietate de alte entități limfoproliferative.
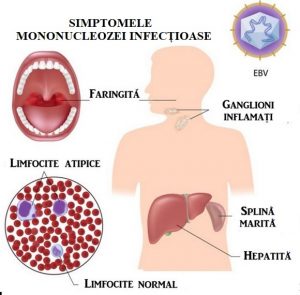
Mononucleoza infecțioasă se caracterizează la debut printr-un prodrom cu stare generală modificată, oboseală urmată de cefalee, febră cu sau fără frison, transpirații, vărsături, dureri abdominale, dureri în gât. Aceste manifestări pot dura 1 – 2 săptămâni. La această simptomatologie necaracteristică, completă sau nu, manifestată intens sau mai puțin intens, se asociază în perioada de stare a bolii o serie de simptome sugestive ca: angina, adenopatiile, hepato – splenomegalia.
Hipertrofia ganglionilor limfatici este întâlnită în 90 – 100% dintre cazuri, dar variabilă (de la dimensiunea unui bob de fasole, la aceea a unei alune). Ganglionii, mai ales cei laterocervicali, sunt dureroși la palpare, fermi la presiune și nu au tendință la supurație. Pot fi afectați ganglionii cervicali (cel mai frecvent), axilari, inghinali, epitrohleeni, mezenterici etc. Limfadenopatia poate persista câteva săptămâni. Limfadenopatia mediastinală poate fi prezentă, dar pune adesea probleme de diagnostic diferențial.
Splenomegalia este moderată și prezentă în 50 – 80% dintre cazuri. Hepatomegalia este relativ frecventă și demonstrează o afectare a ficatului, care clinic apare mai rar, dar mult mai frecvent prin testele hepatice. Icterul se observă în 8 – 28% dintre cazuri. Se constată frecvent creșterea transaminazelor serice, ce reflectă afectarea celulei hepatice. Aceste modificări apar după a doua săptămână de boală și dispar complet în câteva săptămâni. Nu s-a constatat evoluția spre hepatită cronică. Erupțiile cutanate de tip rubeoliform sau scarlatiniform sau, mai rar, peteșiale pot să apară în 10 – 30% dintre cazuri.
2) Anomalii ale testelor hepatice: creşteri moderate ale transaminazelor şi ale bilirubinei.
3) Biopsia ganglionară evidenţiază hiperplazie simplă, proliferare histiocitară şi celule hiperbazofile.
4) Puncţia biopsie hepatică relevă hepatită interstiţială cu proliferare histiocitară şi monocite hiperbazofile în spaţiile porte cu discrete leziuni hepatocitare. Aceste date orientează diagnosticul către mononucleoza infecţioasă, diagnostic care necesită confirmare prin examen serologic.
a) Evidenţierea anticorpilor nespecifici, heterofili
Reacţia Paul Bunnel-Davidson-Hăngănuţiu permite evidenţierea anticorpilor heterofili faţă de eritrocitele de oaie. Aceşti anticorpi apar în titru semnificativ în cursul mononucleozei infecțioase, şi în titruri mici la persoanele normale, la cele care au primit ser de cal, sau în alte situaţii. Anticorpii heterofili sunt produşi ca urmare a stimulării virale a celulelor B de către virusul Epstein – Barr sau a agresării lor de către celulele T.
Anticorpii din mononucleoza infecțioasă sunt specific adsorbiţi de către hematiile de bou, în timp ce anticorpii heterofili apăruţi în alte situaţii sunt adsorbiţi de rinichii de cobai.
Titrul de la care se consideră reacţia pozitivă este de 1 / 40, cu creştere în dinamică în cursul infecţiei acute.
b) Evidenţierea anticorpilor specifici anti-virus Epstein-Barr
Se menţin în circulaţie, pe toată durata vieţii: anticorpii IgG anti-VCA, anti-EBNA şi cei fixatori de complement.
Testele utilizate sunt ELISA şi testul de imunofluorescenţă indirectă. Seroconversia (creşterea de 4 ori a titrului de anticorpi în serul I faţă de serul II) este semnificativă pentru diagnostic.
Teste diagnostic pentru mononucleoza infecțioasă
|
6) Izolarea patogenului
În marea majoritate a cazurilor de mononucleoză infecțioasă, evoluția este benignă. Febra și faringoamigdalita persistă, în general, aproximativ 2 săptămâni, în timp ce adenopatiile, organomegalia (spleno-hepatomegalia) și starea de indispoziție pot dura până la 6 săptămâni. O serie de forme severe apar în stări de imunodeficiență (ca în sindromul Duncan – sindromul limfoproliferativ X – linkat ) sau sunt asociate cu complicații (neurologice, respiratorii, hematologice, cardiace, suprainfecții bacteriene, ruptura splinei). O formă particulară de evoluție a mononucleozei infecțioase este sindromul de mononucleoză infecțioasă cronică, ce poate dura luni sau chiar ani; o manifestare particulară este sindromul de oboseală cronică. S-a demonstrate faptul că infecția cu virusul Epstein – Barr poate predispune la reprize viitoare de amigdalită recurentă și abcese periamigdaliene.
Virusul poate persista în faringe luni sau ani, fiind o potențială sursă de reinfecție sau de transmitere. Pacienții cu imunodeficiențe moștenite sau câștigate – ca SIDA, boala limfoproliferativă X-linkată și imunosupresia posttransplant – pot dezvolta sechele severe ca rezultat al proliferării necontrolate a celulelor B. Limfomul Hodgkin și limfomul non – Hodgkin, limfomul Burkitt și carcinomul nazofaringian au fost corelate cu aceste anomalii imunologice. Există, de asemenea, o evidență în creștere a efectelor adverse ale imunosupresiei care constau în obstrucții semnificative ale căilor aeriene datorate hiperplaziei adenoamigdaliene la un larg număr de pacienți cu infecție cu virusul Epstein – Barr.
Tratamentul în formele fruste și comune de mononucleoză infecțioasă constă în: repaus la pat și izolare timp de 10 – 14 zile. Nu există un tratament antiviral specific. Terapia cu doze mari de Aciclovir scade replicarea virală și extinderea din orofaringe a infecției, în cursul perioadei de administrare, dar nu reduce severitatea sau durata simptomelor și nici nu modifică eventuala evoluție a bolii. În cele mai multe cazuri, repausul la pat, administrarea adecvată de lichide și de analgezice sunt adecvate terapiei simptomatice a mononucleozei infecțioase.
La pacienții cu forme severe (febră mare, adenopatii enorme, hepatită sau stare tifică), ca și în cazurile cu complicații respiratorii (obstrucție incipientă a căilor respiratorii), cu convulsii, meningită, anemie hemolitică, trombocitopenie însoțită de hemoragii se recurge la o terapie cu Prednison 1 mg/kg/zi (maxim 60 mg/24 ore) sau echivalente, timp de 7 zile, cu reducere progresivă în alte 7 zile. Pentru suprainfecțiile bacteriene (angine streptococice) se recurge la antibiotice adecvate. La pacienții, în particular la cei cu compromiterea respirației din cauza unei măriri exagerate a amigdalelor, plasarea unei „trompete“ nazofaringiene sau o intubație endotraheală pot fi necesare sau iminente în rarele cazuri cu obstrucție completă a căilor aeriene.
Adeno – amigdalectomia poate avea un rol important în terapia pacienților cu infecție cronică cu virusul Epstein – Barr. La pacienții sever afectați prin faringoamigdalite recurente, adenoamigdalectomia poate realiza o ameliorare simptomatică prin eliminarea organului țintă. La pacienții imunodeprimați cu hiperplazie adenoamigdaliană, adenoamigdalectomia reduce obstrucția căilor aeriene superioare și, de asemenea, procură un „material biopsic“ pentru diagnosticul unei malignități oculte și al unei boli limfoproliferative posttransplant, în care o intervenție precoce poate influența favorabil evoluția bolii.
© Copyright 2025 NewsMed - Toate drepturile rezervate.