Căutare
Căutare
Toate procedurile
Analiza detaliată
Analiza detaliată
Boala Waldenstrom este o afecţiune care rezultă în urma proliferării maligne a unor celule cu caracter limfoplasmocitoid, limfocite B cu memorie secretoare de IgM (macroglobulină) cu caracter monoclonal. Macroglobulinemia Waldenstrom reprezintă corespondentul leucemic al limfomului limfoplasmocitoid (formă indolentă de limfom malign non – Hodgkin). Aceasta este o boală relativ rară (incidenţă < 0,5 la 100.000 pe an), cu uşoară predispoziţie pentru sexul masculin (raport sex masculin vs sex feminin de 2 la 1), fiind mai frecventă în jurul vârstei de 60 – 65 ani.
Imunoglobulinele M reprezintă între 5 şi 10% din totalul imunoglobulinelor serice, cu o concentraţie normală de 120 – 150 mg / dl (1,2 – 1,5 mg / ml). Imunoglobulina M este exprimată, sub formă monomerică, ca receptor pentru antigen, pe membrana limfocitelor B. Forma circulantă se prezintă sub formă de polimer (cel mai frecvent pentamer), solidarizarea monomerilor identici de imunoglobuline M în molecula de pentamer realizându-se cu ajutorul unui lanţ polipeptidic, numit lanţ J şi a mai multor legături disulfidice.
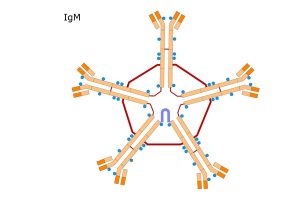
Structura imunoglobulinelor M
Cele mai importante caracteristici funcţionale ale imunoglobulinei M sunt:
Cauza bolii Waldenstrom este necunoscută. În apariția acesteia sunt incriminaţi factori genetici, factori toxici (azbestul) şi factori virali (HTLV-I, virusul uman limfotropic T). Celula care proliferează este situată pe o treaptă înaintată de diferenţiere şi asociază caractere ale limfocitului mic şi ale plasmocitului. Această celulă limfoplasmocitară poate fi întâlnită în circulaţie, ceea ce explică aspectele subleucemice sau leucemice, adesea constatate în , precum şi expansiunea procesului neoplazic în splină, ganglioni limfatici, ficat şi în alte viscere sau ţesuturi. Pot astfel apărea, în evoluţia bolii, fenomene de insuficienţă medulară (cu anemie, tendinţă la infecţii, fenomene hemoragipare), hepatosplenomegalie, adenopatii, semne de afectare a altor organe. Acumularea IgM în plasmă modifică vâscozitatea şi scurgerea sângelui, înveleşte elementele figurate şi factorii de coagulare, cu consecinţe similare celor descrise la mielomul multiplu. De asemenea, apar complexe IgM și IgG care se pot comporta ca şi crioglobuline sau ca factor reumatoid, provocând fenomene de tip Raynaud şi de poliartrită reumatoidă, sau se pot depune în pereţii vaselor mici din piele şi glomerulii renali.
Şi în boala Waldenstrom apar disfuncţii ale sistemului imunitar răspunzătoare de creşterea incidenţei infecţiilor sau de apariţia citopeniilor autoimune. Amiloidoza este mai rară decât în mielomul multiplu şi se poate însoţi de sindrom nefrotic.
Debutul bolii este insidios, cu astenie, scădere ponderală, paloare, anorexie. În evoluţia bolii, apar fenomene hemoragipare (epistaxis, gingivoragii, purpură). Adesea este prezentă intoleranţa la frig, tulburări de vedere, manifestări neurologice (radiculite, nevralgii) şi poliartralgii mimând poliartrita reumatoidă. Polineuropatia are caracter progresiv şi este cauzată de depunerea de IgM în tecile mielinice sau de leziuni în „vasa nervorum”. Precipitarea intravasculară de crioglobulină se va manifesta clinic prin acrocianoză (se manifestă prin colorație albastru – violacee a extremităților – urechi, mâini, picioare și uneori a feței, permanentă și mai puțin dureroasă, accentuată de frig), fenomene Raynaud, urticarie „a frigore”, purpură, artralgii sau chiar accidente vasculare cerebrale. Când vâscozitatea serului este foarte crescută apar manifestări clinice ale sindromului de hipervâscozitate similare cu cele din mielomul multiplu şi care pot merge până la coma „paraproteinemică”. Aproximativ 25% din cazuri pot evolua cu un tablou clinic atenuat sau pot fi asimptomatice.
Examenul clinic – obiectiv evidenţiază adenopatiile, uneori generalizate, hepato – splenomegalia (moderată) şi modificările cutanate cauzate de precipitarea crioglobulinei.
Acesta detectează, în cele mai multe cazuri, anemia moderată, cu eritrocite dispuse în rulouri. Numărul leucocitelor este normal, adesea însă este prezentă o leucocitoză cu caracter subleucemic. Trombocitopenia, relativ frecventă, este urmarea insuficienţei medulare şi a distrugerii autoimune. În cazurile cu anemie hemolitică, testul Coombs este pozitiv.
Acesta pune în evidenţă o măduvă hipercelulară, cu predominanţa celulelor limfoplasmocitare ce au incluzii intracitoplasmatice PAS pozitive (formate din Ig), un procent uşor crescut de plasmocite. Examinarea biopsiei osteo – medulare relevă un infiltrat tumoral predominant de tip intertrabecular.
Explică accelerarea VSH-ului (viteza de sedimentare a hematiilor), creşterea titrului proteinelor plasmatice, cu hipergamaglobulinemie de tip monoclonal prin creşterea IgM (îndeosebi cu lanţuri uşoare kapa), scăderea titrurilor IgG şi IgA, test Sia pozitiv, uneori caracterul de crioglobulină al IgM. Proteinuria Bence – Jones este mai rară decât în mielomul multiplu.
Acesta permite diagnosticul pozitiv şi cel diferenţial (de alte limfoproliferări B): pozitivitate pentru markerii pan-B (CD19, CD20, CD22, CD79), IgM membranare, negativitate pentru CD10, CD23, CD103, CD138, pozitivitate slabă, rară pentru CD5.
Se recomandă tomografia computerizată a toracelui, abdomenului şi pelvisului, în scopul cuantificării determinărilor ganglionare, a splenomegaliei, evidenţierea altor localizari extramedulare de boală. Rezonanţa magnetică nucleară poate fi utilizată pentru evaluarea extensiei determinărilor osteo-medulare.
Apar modificările datorate hipervâscozităţii (vase tortuoase, cu aspect de „cârnăciori”, edem papilar, microhemoragii), mai ales dacă valorile IgM depăşesc 3000 mg / dl.
7) Examenul citogenetic – la circa jumătate dintre pacienţi se poate observa deleţia 6q fără a fi însă clarificat încă impactul diagnostic şi/sau prognostic al acestei anomalii. Studiul citogenetic nu este indicat de rutină.
8) Valorile scăzute ale albuminemiei (sub 3,5 – 4 g / dl) şi cele crescute ale beta-2-microglobulinei (peste 3 – 3,5mg/l) sunt considerate elemente de prognostic negativ.
9) Funcţiile hepatice şi renale – sunt deseori alterate, prin infiltrat de boală sau depunere de amiloid.
Diagnosticul pozitiv al bolii Waldenstrom se bazează pe patru grupe de criterii și anume:
|
Diagnosticul diferenţial al bolii Waldenstrom se face cu:
Evoluția bolii este variabilă, cel mai adesea progresivă, cu supravieţuiri de la 2 – 3 ani la peste 10 ani. Decesul se produce în urma complicaţiilor: infecţii (îndeosebi pulmonare), hemoragii, complicaţii neurologice legate de sindromul de hipervâscozitate (cu comă paraproteinemică), mai rar insuficienţă renală.
În formele cu evoluţie lentă (aparent staţionare), bolnavul se urmăreşte cu atenţie (clinic şi laborator), tratamentul fiind amânat. Pacienţii asimptomatici, cu valori ale beta-2-microglobulinei sub 3 g / dl şi hemoglobina > 12 g / dl pot avea o evoluţie indolentă a bolii, nefiind nevoie de terapie mult timp, chiar dacă valorile IgM monoclonale sunt crescute (de exemplu, peste 3000 mg / dl).
Terapia specifică devine necesară în următoarele situații:
Mijloace terapeutice utilizate sunt:
Se face pentru tratamentul infecţiilor, tratamentul hiperuricemiei, tratamentul insuficienţei renale. În prezenţa sindromului de hipervâscozitate, transfuziile de masă eritrocitară se vor administra cu prudenţă, existând pericolul creşterii la valori critice ale vâscozităţii sanguine.
Aceasta reduce simptomele asociate sindromului de hipervâscozitate, manifestările datorate polineuropatiei.
Se va adresa mecanismului generator predominant. Anemia hipocromă, microcitară prin tulburărea metabolismului fierului (utilizare neeficientă) nu răspunde la preparate orale, fiind necesare preparate cu administrare intravenoasă.
Citostatice utilizate în terapia bolii Waldenstrom, ca şi monoterapie sau în diferite combinaţii, sunt:
a) Agenţi alkilanţi: Clorambucil (6 – 10 mg pe zi, 7 – 14 zile, cicluri repetate la 28 zile), Ciclofosfamida, Melphalan (Alkeran), singuri sau în asociere cu cortizonice (Prednison, Metilprednisolon sau Dexametazonă). Schemele sunt similare celor din mielomul multiplu sau limfomului non – Hodgkin cu malignitate redusă; tratamentul se opreşte după obţinerea remisiunii (restabilirea clinică şi hematologică, dispariţia organomegaliei, reducerea componentului monoclonal) şi se reia la recădere.
b) Analogi purinici – în principal, Fludarabina (scheme identice cu cele din leucemia limfatică cronică), mai rar Cladribina (scheme identice cu cele din leucemia cu celule păroase); ratele de răspuns şi calitatea remisiilor sunt superioare Clorambucilului, însă şi complicaţiile secundare imunosupresiei sunt mai frecvente. Pentru creşterea eficienţei se utilizează asocierea Fludarabină cu Ciclofosfamidă sau Rituximab cu Fludarabină cu Ciclofosfamidă.
c) Anticorpi monoclonali:
Chimioterapia “high – dose” urmată de transplant de celule stem hematopoietice este singurul mijloc terapeutic cu potenţial curativ. Datorită morbidităţii şi mortalitaţii asociate procedurii, este însă indicată doar cazurilor selecţionate, la tineri.

Accident ischemic tranzitor , Accident vascular cerebral (AVC) , Cefaleea - durerea de cap Epilepsia

Hipertensiunea arteriala (HTA) , Gastroenterita , Pielonefrita acută Lupusul eritematos sistemic - LES
© Copyright 2025 NewsMed - Toate drepturile rezervate.