Căutare
Căutare
Toate procedurile
Analiza detaliată
Analiza detaliată
Este uimitor cum un organism ia naștere dintr-o singură celula și cum celulele sănătoase le înlocuiesc pe cele suferinde în organismul adult. S-a descoperit un tip particular de celule care fac posibile toate aceste lucruri: celulele stem. Acest domeniu promițător al științei investighează posibilitatea tratării bolilor prin terapii celulare, astfel luând naștere o nouă arie a medicinii, numită medicină regenerativă sau reparatorie.
Ovulul fertilizat este totipotent, având potențialul de a genera toate celulele și țesuturile care formează un embrion și permit dezvoltarea lui în uter. După fertilizare, ovulul se divide și se diferențiează până produce un organism matur. Mamiferele adulte, inclusiv omul, sunt formate din aproximativ două sute de tipuri celulare. Acestea includ, printre altele: neuronii, celulele musculare (miocite), celulele din piele (epiteliale), celulele din sânge (eritrocite, monocite, limfocite, etc), celulele osoase (osteocite) și celulele din cartilaj (condrocite). Alte celule, esențiale pentru dezvoltarea embrionului, dar care nu sunt încorporate în corpul embrionului formează țesuturile extraembrionare, placenta și cordonul ombilical. Toate aceste celule sunt generate dintr-o singură celulă, totipotentă, numită zigot sau ovul fertilizat.
Majoritatea cercetătorilor folosesc termenul “pluripotent” pentru a descrie celulele stem care formează toate tipurile celulare derivate din cele trei foițe embrionare: mesoderm, endoderm, ectoderm. Aceste foițe embrionare constituie sursa tuturor celulelor din organism. Toate tipurile specializate de celule care formează organismul derivă din una din cele trei foițe. Celulele pluripotente au capacitatea de a forma orice tip celular, proprietate observată în dezvoltarea embrionară și în unele condiții de laborator. Celulele din organismul adult sunt în general multipotente, sunt capabile de diferențiere într-unul sau mai multe tipuri celulare. Acest proces permite formarea sau reînnoirea țesuturilor. În cazul în care țesuturile sunt lezate devine necesară înlocuirea acestora, celulele stem se pot atunci activa pentru a repara leziunile.
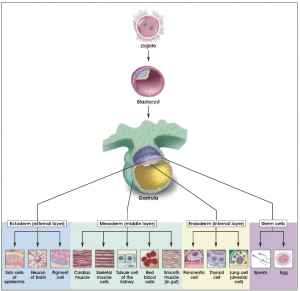
Straturile embrionare progenitoare de țesuturi |
|
| Straturi embrionare |
Țesuturi diferențiate |
|
Endoderm |
|
|
Mezoderm |
|
|
Ectoderm |
|
Celulele sângelui sunt responsabile pentru menținerea constantă și protecția imună a tuturor tipurilor celulare din organism. Aceste celule, alături de cele din piele prezintă o mare capacitate de autoreînnoire comparativ cu oricare alt țesut adult. Celulele stem care formează sângele și celulele sistemului imunitar sunt cunoscute drept celule stem hematopoietice. Acestea sunt responsabile de înnoirea constantă a sângelui – producția bilioanelor de noi celule sangvine din fiecare zi.
Numeroase studii au evidențiat prezența a două tipuri de celule stem hematopoietice: cu viață lungă, capabile de autoreînnoire și cele cu viață scurtă. Celulele stem cu viață lungă introduse în animale al caror sistem hematopoietic a fost iradiat, au capacitatea de a reface acest sistem în câteva luni. Celulele stem hematopoietice cu viață scurtă pot regenera imediat toate tipurile celulare prezente în sânge, însă în condiții normale nu se pot autoreînnoi, fapt pentru care li s-a acordat denumirea de progenitori sau precursori cu viață scurtă. Progenitorii sau precursorii sunt în general, celule imature care pot forma anumite tipuri celulare complet diferențiate. Sunt capabili de proliferare, însă au capacitate limitată de diferențiere în mai mult de un singur tip celular (spre exemplu, un progenitor celular poate forma o celulă roșie din sânge).
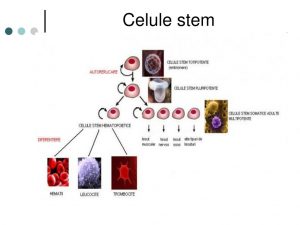
Diferențierea celulelor stem hematopoietice
Există o mare dificultate în identificarea celulelor stem hematopoietice. Fie datorită existenței tipurilor multiple de celule stem, fie aspectului asemănător al acestora cu al altor specii celulare prezente în sânge sau în măduva osoasă. Cel mai folosit criteriu în identificarea celulelor stem hematopoietice s-a dovedit a fi evidențierea markerilor de suprafață specifici.
Markerii celulari de suprafață pentru identificarea celulelor stem hematopoietice nediferențiate |
|
| La șoarece | La om |
| CD34- | CD34+ |
| SCA-1+ | CD59+ |
| CD38+ | CD38- |
| C-kit+ | C-kit– |
Tabelul cuprinde markerii de suprafață ai celulelor stem hematopoietice umane și de șoarece aflate în stadiu nediferențiat, markeri prezenți atât in vivo, cât și in vitro. Când celulele încep să se diferențieze ca linii celulare distincte, markerii de suprafață nu mai sunt prezenți. Grupul celulelor sortate după markerii de suprafață este heterogen și cuprinde: celule stem cu viață lungă capabile de autoreînnoire, unii progenitori cu viață scurtă și câteva celule non – stem.
Sursa clasică de celule stem hematopoietice o reprezintă maduva osoasă. Transplanturile de maduvă osoasă se practicau încă în urmă cu 40 – 50 de ani. Celulele erau recoltate prin puncție osoasă, cu precădere din creasta iliacă. S-a dovedit că una din 100.000 celule din maduva osoasă este o celula capabila de multiplicare pe termen lung, celulă formatoare de sânge. Alte celule fiind reprezentate de: celule stromale, celule progenitoare ale sângelui, precum și celule mature sau în curs de maturare, albe și roșii.
O altă sursă de celule stem sangvine o constituie sângele periferic, circulant. Este cunoscut de multă vreme că un numar scăzut de celule stem și progenitori celulari circulă în sângele periferic, însă în urmă cu câțiva ani s-a descoperit că se poate determina migrarea celulelor stem din maduva osoasa în sânge prin administrarea unei citochine, cum ar fi factorul stimulator de colonii granulocitare (G-CSF, granulocyte colony-stimulating factor). S-a observat că 5 până la 20% din celulele recoltate sunt reprezentate de celule stem hematopoietice. În ultimii ani, se pune un accent tot mai mare pe transplanturile autologe sau alogene cu celule nucleate sangvine recoltate din sângele periferic. S-a constatat că sângele periferic conține de două ori mai multe celule stem hematopoietice decât măduva osoasă. Astfel, în cazul acestor transplante recuperarea se realizează mai repede.
La începutul anilor 1990, s-a observat că sângele din cordonul ombilical și placenta este bogat în celule stem hematopoietice. Acest țesut realizează dezvoltarea fetusului în timpul vieții intrauterine. Celulele stem recoltate din sangele placentar ombilical au fost folosite cu succes în realizarea transplanturilor. De asemenea, s-a demonstrat că aceste celule stem, comparativ cu celulele stem din măduva osoasă sunt multipotente, având capacitatea de a dezvolta celule din cele trei straturi embrionare, sau chiar din toate cele trei straturi embrionare: endoderm, ectoderm, mezoderm (pluripotente). Nu s-au demonstrat diferențe calitative între celulele diferențiate provenite din celule stem hematopoietice recoltate din sângele din cordonul ombilical, sângele periferic și măduva osoasă.
O sursă de celule stem sangvine folosită în cercetare, însă nu și în clinică o reprezintă sângele fetal. Celulele hematopoietice apar timpuriu în dezvoltarea tuturor vertebratelor. Majoritatea celulelor stem care există în măduva osoasă adultă și în circulație sunt derivate din celule care apar târziu în cursul vieții intrauterine și localizate altundeva decât în sacul vitelin. Cele mai multe studii care vizează celulele stem fetale folosesc celule recoltate de la șoareci sau alte animale, însa există puține informații despre celulele stem hematopoietice fetale și embrionare umane.
S-a arătat că este posibil să se obțină precursori pentru multe tipuri celulare sangvine din celule stem embrionare de șoarece. De asemenea, s-a reușit obținerea in vitro a tuturor liniilor majore de progenitori celulari din corpii embrioizi proveniți de la șoareci, chiar și fără adăugarea factorilor de creștere hematopoietici. Dar celulele hematopoietice derivate din celule stem embrionare și germinale umane nu au fost riguros testate în privința capacității lor proliferative pe termen lung și în ceea ce priveste abilitatea de a forma toate tipurile celulare sangvine.
O celulă stem hematopoietică prezinta patru caracteristici:
S-a dovedit dificil de multiplicat și menținut in vitro celule stem capabile să-și păstreze aceeași capacitatea de autoreînnoire și diferențiere cu cea existentă la celulele din organism. S-a observat că în cultură apare diferențierea acestor celule către progenitori ce formează diferite linii sangvine, care însă își pierd capacitatea de autoreînnoire. Se cunoaște că celulele stem « adevarate » se divid și se înlocuiesc cu o rată scăzută în măduvă osoasă adultă.
S-a observat că pentru menținerea in vitro a acestor celule este necesară folosirea factorilor de creștere. Astfel, s-a arătat că două citochine: factorul celulelor stem și trombopoietina, determină diviziunea inegală, în urma căreia una din celulele fiice rezultate dă naștere unui descendent cu potențial de autoreînnoire. Folosirea in vitro a citokinelor și moleculelor de adeziune specifice a determinat o ușoară creștere a numărului celulelor stem.
Funcția principală a celulelor stem sangvine o constituie formarea celulelor albe și roșii prezente în sânge. S-a constatat că în timpul producerii unei celule mature, circulanta, prezentă în sange, celula stem hematopoietică originală realizează între 17 – 19,5 diviziuni. Un rol decisiv în diferențierea progenitorilor către diferite tipuri celulare îl dețin factorii de creștere și citochinele.
Se știe că celulele stem hematopoietice se găsesc în conexiune intimă cu stroma medulară. Însă, astfel de celule sunt prezente și în splină, circulația periferică și alte țesuturi. Conexiunile cu interstițiul măduvei osoase sunt importante în susținerea transplanturilor cu celule stem, precum și pentru menținerea acestora ca o populație capabilă de autoreînnoire. Conexiunile cu stroma sunt de asemenea, importante în proliferarea, diferențierea și maturarea celulelor sangvine.
S-a observat că celulele stem care sunt mobilizate din măduva osoasă către circulația periferică sunt cu precădere celule care nu se divid. Moleculele de adeziune din stromă joacă un rol important în mobilizare, în atașarea celulelor la stromă precum și în transmiterea semnalelor ce reglează autoreînnoirea celulelor stem hematopoietice și diferențierea progenitorilor.
S-a reușit inducerea diferențierii celulelor stem hematopoietice din măduva osoasă în alte tipuri celulare: creier, mușchi și ficat. Studiile pe șoareci au arătat că grefele de măduvă osoasă sau de celule stem sangvine s-au dovedit eficiente în regenerarea mușchilor scheletici și cardiaci, precum și a ficatului lezat. Astfel, s-a reușit tratarea distrofiei musculare cu ajutorul transplantului de măduvă osoasă provenită de la animale sanatoase. De asemenea, s-a demonstrat integrarea celulelor stem hematopoietice în alte țesuturi decât cel de origine. S-a dovedit că o singură celula stem hematopoietică selectată poate determina mai mult decât repopularea măduvei osoase. Celulele stem hematopoietice pot crește și în alte țesuturi ca răspuns la infecții sau ca urmare a leziunilor produse în urma iradierilor.
În prezent, abordările terapeutice în bolile sistemului nervos constau în identificarea simptomelor și limitarea leziunilor. Odată cu descoperirea celulelor stem neuronale s-au conturat noi posibilități de tratament. S-a constatat că celulele stem neuronale pot forma toate tipurile celulare prezente în creier; neuroni funcționali (care se integrează în țesut realizând sinapse), celule gliale și oligodendrocite.
Descoperirea capacității regenerative a sistemului nervos central la adult oferă speranțe în tratamentul bolilor degenerative precum boala Parkinson. S-au evidențiat doua strategii în încercările de restabilire a funcțiilor nervoase. Prima constă în multiplicarea și diferențierea celulelor in vitro și apoi transplantarea lor la pacienți. Se urmărește administrarea celulelor diferențiate în neuroni din celule stem, sau direct implantarea celulelor nediferențiate, integrarea și maturarea acestora în zona afectată. Pot fi utilizate în acest scop o varietate de celule: precursorii neuronali deja “committed” către un anumit tip celular, fie celule embrionare pluripotente. O altă strategie reparatorie o constituie utilizarea “factorilor trofici” ca: factori de creștere, hormoni și alte molecule de semnalizare care ajută la supraviețuirea și creșterea celulelor, putând determina stimularea celulelor stem și mecanismele reparatorii endogene. În acest fel se pot reface zonele afectate și restaura funcțiile țesutului lezat.
Boala Parkinson apare după vârsta de 50 ani și constă în degenerarea progresivă a neuronilor prezenți în creier. Simptomele se manifestă de cele mai multe ori printr-un tremur necontrolat al mâinilor, urmat apoi de o rigiditate crescută, dificultăți în mers precum și dificultăți în inițierea mișcărilor voluntare. Acestea se datorează morții unui tip particular de neuroni prezenți in creier. Acești neuroni conectează o structură din creier numită substanța neagră cu o altă formațiune anatomică – striatum, parte componentă a nucleului caudat și a putamenului. Acești neuroni “nigro – striați” eliberează dopamina spre neuronii țintă din striatum. Una din funcțiile majore ale dopaminei o reprezintă reglarea nervilor care controlează mișcările organismului. Odată cu moartea acestor celule, este produsa mai puțină dopamină, ceea ce duce la apariția dificultăților în mișcare caracteristice bolii Parkinson.
Se încearcă identificarea unei combinații optime între factorii de creștere și condițiile de cultivare în vederea menținerii celulelor in vitro din stadiu de nediferențiate până la punctul în care ele devin committed către neuroni dopaminergici. Urmeză apoi implantarea lor în creierul afectat unde își încheie creșterea și diferențierea. O altă posibilitate o reprezintă transplantarea celulelor nediferențiate în creierul lezat și diferențierea lor sub influența semnalelor din micromediul existent în tipul celular adecvat necesar înlocuirii celulelor afectate. De asemenea, s-a încercat utilizarea transplanturilor de celule stem din surse embrionare sau adulte în scopul inducerii organismului să-și declanșeze propriile mecanisme reparatorii. O altă strategie constă în combinarea terapiilor medicamentoase cu cele care vizează utilizarea celulelor stem. Terapia regenerativă în boala Parkinson constă în înlocuirea unui singur tip celular aflat într-o singură regiune din creier, ceea ce reprezintă o țintă relativ ușoară comparativ cu celelalte boli neuronale degenerative.
Datorită potențialului de diferențiere către multiple tipuri celulare, celulele stem au fost utilizate și în scopul restabilirii funcțiilor măduvei spinării după injuria acesteia. Restaurarea completă după lezarea majoră a măduvei spinării constituie o mare problemă. Multe tipuri celulare sunt distruse în aceasta injurie, inclusiv neuronii care realizează conexiunile între creier și restul organismului. În multe astfel de cazuri nu toți neuronii purtători de semnale au axonii lezați, însă axonii acestora nu mai pot transmite impulsul nervos, deoarece oligodendrocitele care izolează axonii cu mielina sunt distruse. S-a realizat încercarea de înlocuire a oligodendrocitelor. S-a demonstrat că celulele stem pot induce remielinizarea la șobolani. De asemenea, oligodendrocitele diferențiate din celule stem embrionare pot restabili remielinizarea axonilor în modelele animale de paralizii ale măduvei spinării.
O atenție deosebită în cercetare este acordată bolilor autoimune. Rămâne încă o enigmă mecanismul care determină sistemul imun să-și atace propriile celule, țesuturi, organe. Elucidarea acestei probleme este necesara in înțelegerea bolilor autoimune ca poliartrita reumatoidă, diabetul zaharat de tip I, lupusul eritematos sistemic și sindromul Sjogren. Când unele dintre proteinele celulare din organism sunt recunoscute ca non-self de catre limfocitele T (celule care aparțin sistemului imun) este declanșată o cascada distructivă inflamatorie. Tratamentele curente folosite în combaterea acestor afecțiuni se bazează pe deprimarea răspunsului imun făcând astfel pacienții susceptibili pe parcursul întregii vieți la infecții. Astfel, se încearcă abordarea unor noi tratamente care se bazează pe utilizarea celulelor stem urmărindu-se înlocuirea celulelor anormale cu astfel de celule care au capacitatea de a se diferenția în celule imunitare specifice.
Cauza care determină apariția acestor boli o constituie un dezechilibru între inducerea și menținerea unei toleranțe imune scăzute. Apare astfel, o distrugere a celulelor și țesuturilor de către limfocitele T citotoxice (CD8) sau de autoanticorpi, fenomen însoțit și de un proces inflamator. Acest mecanism poate duce la distrugerea articulațiilor în artritele reumatoide, a celulelor beta – pancreatice producătoare de insulină în diabetul zaharat de tip I sau la afectarea rinichilor în lupusul eritematos sistemic. Mecanismul defectiv al inducerii și menținerii toleranței rămâne încă neelucidat. Se știe că printre cauzele apariției acestor boli le constituie: factorii genetici, hormonali, precum și unele infecții.
Leziunile mediate imun pot fi organ – specifice, cum sunt cele din diabetul zaharat de tip I, caracterizat prin distrugerea celulelor beta – pancreatice sau scleroza multiplă, datorată distrugerii tecii de mielină. Tratamentul acestora presupune repararea sau înlocuirea celulelor și țesuturilor lezate. Spre deosebire, bolile autoimune non – organ specifice (spre exemplu, lupusul eritematos sistemic) sunt caracterizate prin leziuni larg răspândite, datorate reacțiilor imune care au loc în multe organe și tesuturi. Obstacolul major în tratamentul acestora constituindu-l lipsa unei ținte specifice.
În tratamentul lupusului eritematos sistemic se încearcă distrugerea celulelor imune mature și autoreactive, urmând apoi înlocuirea acestora cu celule stem hematopoietice. Pentru a nu apărea probleme de histocompatibilitate sunt folosite transplanturile autologe. S-a constatat că această modalitate de reînnlocuire poate însa altera sistemul imun al pacientului supus acesteia.
Posibilitatea de a genera și propaga în numar mare celule stem hematopoietice în afara organismului, fie că acestea provin din sângele din cordon ombilical, surse adulte, fetale sau embrion furnizează siguranță, costuri mici precum și celule viabile. Cu toate că celulele stem embrionare oferă avantaje comparativ cu cele provenite din cordonul ombilical sau din măduva osoasă, celulele stem hematopoietice rămân însă cele mai utilizate în astfel de terapii. Se cunoaște că celulele stem hematopoietice, fie că provin din sângele din cordonul ombilical, fie din măduva osoasă hematogenă prezintă un potențial de autoreînnoire limitat comparativ cu cele embrionare, însă oferă avantajul că pot fi prelevate de la indivizi sănătoși, cu factori de predispoziție genetică bine definiți.
În prezent, „atacurile” de cord și bolile congestive ale inimii constituie principala cauză de deces. În pofida modalităților de prevenire a bolilor cardiovasculare, restaurarea funcțiilor unei inimi lezate rămâne în continuare o problemă. Studiile au evidențiat că celulele stem adulte și embrionare pot înlocui celulele miocardului lezat și pot genera noi vase de sânge. Se cunoaște că distrugerea celulelor miocardice, cunoscute drept cardiomiocite se poate datora hipertensiunii arteriale, insuficienței cardiace cronice apărute în vascularizația inimii cauzată de boli arteriale coronariene, atacurile de cord, obstrucția vaselor sangvine ale cordului.
Un rol decisiv în funcționarea inimii îl dețin cardiomiocitele a căror contracție determină expulzarea sângelui din ventriculi către artere. Alte două tipuri celulare care intră în alcătuirea cordului sunt: celulele endoteliale vasculare care formează stratul intern al vaselor sangvine și celulele musculare netede care formează peretele vaselor de sânge. Inima prezintă o vascularizație bogată, iar aceste celule specializate sunt importante pentru dezvoltarea unei noi rețele de arteriole care asigură hrănirea și oxigenarea cardiomiocitelor. Potențialul celulelor stem embrionare și adulte de a se diferenția în aceste tipuri celulare a fost exploatat ca o strategie pentru restaurarea funcțiilor cardiace la persoanele cu infarct miocardic sau boli congestive. În condiții specifice de laborator s-a reușit diferențierea celulelor stem în cardiomiocite și celule endoteliale vasculare.
Asemeni celulelor stem de la șoareci, celulele stem hematopoietice umane pot forma in vitro numeroase tipuri celulare, inclusiv mușchi cardiac. Injectate în circulația șoarecilor cu infarct de miocard, aceste celule previn moartea prin hipertrofie a celulelor cardiace viabile și reduc formarea progresivă a fibrelor de colagen.
Studiile realizate pe modele animale au evidențiat faptul că celulele stem adulte se pot diferenția în multiple tipuri celulare. Aceasta capacitate, denumită plasticitate, face din aceste celule candidați viabili în repararea tisulară.
Diabetul zaharat este una dintre cele mai răspândite boli de pe glob şi cea mai frecventă boală din patologia endocrină. Se caracterizează prin tulburări ale întregului metabolism (proteic, lipidic, glucidic, hidro-electrolitic și acido-bazic), în principal afectând metabolismul glucidelor. Afectează circa 5% din populația generală în țările dezvoltate, dar 50% dintre cazuri rămân nediagnosticate. În țările dezvoltate, diabetul zaharat este principala cauză de cecitate la pacienții cu vârsta mai mică de 60 ani.
Pacienții cu diabet zaharat tip I trebuie să-și administreze insulina de câteva ori pe zi și să-și controleze concentrația glucozei de 3 – 4 ori în cursul aceleiași zile. Devine astfel foarte importantă monitorizarea glicemiei, deoarece prin menținerea unui nivel de glucoză în sânge cât mai apropiat de cel normal se reduce semnificativ riscul apariției complicațiilor. În cazul diabetului zaharat de tip I , singura modalitate de tratament o constituie transplantul de pancreas. Însă pentru a se reduce riscul rejetului este necesară administrarea medicamentelor imunosupresive care determină riscul apariției altor boli, cu precădere boli renale. De aceea, cele mai multe transplanturi de pancreas sunt însoțite de transplanturi renale.
De-a lungul anilor s-au încercat numeroase modalități de tratament a diabetului zaharat. Una din aceste tehnici constă în injectarea la pacienți a celulelor insulare pancreatice, însă în acest fel nu s-a reușit depașirea tratamentului imunosupresor. S-a observat că corticosteroizii deteriorează mult mai mult celulele administrate, comparativ cu transplantul de pancreas. Un alt dezavantaj este acela că celulele transplantate sunt recoltate de la cadrave și procedura necesită cel puțin două cadravre pentru un transplant. Intervine și problema imunocompatibilității, iar țesutul trebuie obținut în primele ore de la deces.
„Stem cell research must be carried out in an ethical manner in a way that respects the sanctity of human life.” (John Boehner)
Utilizarea celulelor stem în clinică, ca metodă curentă, trebuie să ţină cont de trei parametri: comunitate, donator şi primitor sub aspectul siguranţei, beneficiului, design-ului experimental şi consimţământului informat; iar relaţia dintre acestea trebuie intermediată de medic în baza cadrului etic şi legislativ. Astfel, în orice moment al unui studiu trebuie avută în vedere respectarea prevederilor unor documente precum Raportul Belmont, Codul Nuremberg, Declaraţia de la Helsinki pentru cercetarea medicală pe subiecţi umani, Ghidul de etică pentru cercetarea biomedicală pe subiecţi umani al Organizaţiei Mondiale a Sănătaţii, Directivele pentru trial-uri clinice ale Comisiei Europene.
Aspecte etice, legale şi religioase în transplantul celulelor stem |
||
Xenotransplant |
Allotransplant |
|
| = sunt transplantul de celule vii, țesuturi sau organe de la o specie la alta; se mai numește transplantul heterolog. | = transplantul de celule, țesuturi sau organe la un destinatar dintr-un donator genetic care nu este identic din aceeași specie. | |
Etic |
|
|
Legal |
consimţământul informat în raport cu:
|
consimţământul informat în raport cu:
|
Religios |
|
|
Acest aspect face referire la utilizarea echitabilă a celulelor şi la impactul economic pe care îl are utilizarea terapiilor celulare asupra sistemului de sănătate.
Echitatea se traduce prin accesul liber şi nediscriminativ al indivizilor pentru care aceste terapii reprezintă o soluţie. Accesul nu trebuie să ţină cont de vârsta, rasa, religia, etnia, sexul, puterea economică sau orientarea sexuală a pacienţilor, ci numai de respectarea indicaţiilor şi criteriilor de selecţie.
Pentru ca accesul să fie nerestricţionat şi din punct de vedere tehnic, se impune existenţa unei baze largi de selecţie imunologică a unor donatori care să cuprindă o diversitate imunologică cât mai mare, lucru ce se traduce prin existenţa băncilor de celule stem. Pe lângă aceasta este necesară existenţa unor protocoale de lucru cu celulele stem, standardizate şi unitare la nivel global.
În plus, terapiile cu celule stem ar trebui direcţionate către acele sectoare ale patologiei cu gravitate crescută şi pentru care nu există remedii convenţionale. Acest lucru este susţinut şi de cel de al doilea aspect, cel financiar.
Pentru a fi rentabilă, realizabilă şi accesibilă, utilizarea terapiilor celulare necesită un sistem de sănătate potent economic care să finanţeze domeniul fără a crea neajunsuri în alte sectoare. Prin urmare, pentru minimalizarea costurilor se impune utilizarea atentă a acestor metode, pentru cazuri atent selecţionate, şi nu ca metodă curentă de tratament. Tot pentru limitarea costurilor, este mai rentabil a se utiliza un număr redus de linii celulare care să fie stocate pe o perioadă scurtă de timp (care se deservească cererea curenta) decât stocarea a numeroase linii celulare pe o perioadă lungă de timp pentru întâmpinarea unor probleme posibile în viitor.
Face referire la aspecte legate de anonimatul donatorilor şi siguranţa metodelor de recoltare. Anonimatul donatorilor este preferabil, iar dictonul „primum non nocere” trebuie avut în vedere în ceea ce priveşte exploatarea donatorilor, fiind esenţial ca metodele de recoltare să fie minim invazive şi să nu pericliteze siguranţa donatorilor. La acest moment sunt acceptate ştiinţific, etic şi politic pentru recoltarea de celule stem următoarele surse: embrionii umani rezultaţi din fertilizare in vitro, sângele din cordonul ombilical şi donatorii postnatali („adulţi”).
Transplantul celulelor stem operează cu ultima categorie de donatori, din care fac parte ca surse copii mici, adolescenţii şi adulţii. Astfel având în vedere normele de protecţie a drepturilor omului, este necesară reglementarea strictă a condiţiilor în care minorii pot fi utilizaţi ca donatori. Trebuie ţinut cont că donarea ţesuturilor necesare izolării celulelor stem poate fi invazivă, dureroasă şi generatoare de complicaţii direct proporţional cu tipul şi cantitatea de ţesut donat. În plus, metodele de recoltare trebuie să conserve sursa donatoare, evitând depleţia acesteia.
Pe lângă acesta trebuie avută în vedere menţinerea integrităţii psihologice şi a coeziunii sociale, profesionale, familiale şi economice a donatorului, ce pot fi alterate de rezultatele ivite în cadrul screening-ului diagnostic pentru prevenirea transmiterii unor agenţi infecţioşi sau a unor anomalii genetice. Aceste rezultate se pot solda cu pierderea intimităţii, apariţia tensiunilor familiale, discriminare, depresie şi suicid.
Deşi până la acest moment nu au fost raportate reacţii adverse, mai ales după inocularea celulelor stem, care să pună folosirea acestor celule sub semnul îndoielii trebuie acordată atenţie sporită riscurilor şi efectelor adverse ce pot apărea ca urmare a variabilităţii metodelor de izolare, expansionare şi transformare în ţesuturi in vitro. Aceasta obligă la standardizarea protocoalelor de lucru cu celulele stem.
În concluzie, dezideratele etice ale utilizării celulelor stem pentru terapiile celulare trebuie să respecte următoarele puncte:
Reprezintă un instrument obligatoriu oricărui experiment ce utilizează subiecţi umani. Realizarea documentului trebuie să fie clară şi să ţină cont de câteva elemente obligatorii: natura experimentului, siguranţa, intervenţiile necesare, alternativele studiului, participarea liber exprimată / voluntară. Analiza corectitudinii documentelor pentru consimţământ cade în sarcina board-urilor instituţionale. Cel mai dificil şi poate cel mai important aspect al consimţământului este reprezentat de validarea capacitaţii decizionale a voluntarului. Pentru aceasta este esenţial a se ţine cont de competenţele acestuia iar exprimarea punctelor de mai sus să fie realizată cu un limbaj accesibil.
În acelaşi sens, este necesar să se ia în calcul şi starea psiho-emoţională a subiectului la momentul exprimării consimţământului ca urmare a unor stări acute (durere, anxietate) sau a influenţei unor substanţe medicamentoase sau recreaţionale. Astfel, se impune ca în cadrul procesului de obţinere a consimţământului informat să figureze instrumente de cuantificare a capacităţii de decizie a subiectului.
Un alt aspect important specific terapiilor celulare este reprezentat de menţionarea sursei celulelor stem ce poate interfera cu anumite percepte individuale de ordin moral sau religios.
Este necesară realizarea unor criterii de selecţie clare privind alegerea pacienţilor pentru studiul experimental. În primele etape este util acest lucru ca urmare a necesităţii unui număr mic de pacienţi pentru stabilirea siguranţei protocolului sau a insuficienţei resurselor terapeutice, pentru ca în etapele ulterioare să fie necesară uniformizării ştiinţifice a rezultatelor. Pe lângă existenţa criteriilor de selecţie, poate cel mai important este a se insista pe explicarea unor concepţii greşite ale voluntarului. Cea mai frecventă constă în credinţa acestuia că studiul respectiv este realizat în virtutea îngrijirii lui la un standard înalt şi nu pentru a răspunde unor întrebări ştiinţifice; o a doua este reprezentată de negarea existenţei randomizării oarbe în studiu, subiectul fiind convins că medicul curant acţionează în interesul vindecării lui. Ca urmare, trebuie insistat pe explicarea clară a naturii şi scopului studiului.
Donarea de celule stem hematopoietice se face fie din sângele periferic, fie direct din măduva osoasă a oaselor mari și late. Înainte de a dona, veţi putea discuta cu un medic specialist despre fiecare modalitate de donare în parte, iar în final dumneavoastră veţi decide ce metodă preferaţi.
Donarea de celule stem hematopoietice din circulația sanguină se face în doi pași:
În prezent, peste 90% din transplanturile efectuate în lume se fac folosind celule stem hematopoietice recoltate din sânge periferic.
Această procedură nu necesită niciun tratament special înainte. Se face obligatoriu sub anestezie generală, într-o sală operatorie. Măduva se recoltează din oasele mari și late ale bazinului cu ajutorul unui ac și al unei seringi. Pe întreg parcursul procedurii veţi fi în grija unei echipe medicale specializate. Veţi putea pleca acasă la 24 ore de la donare. Refacerea are loc în decurs de o săptămână de la donare.
În prezent, aproximativ 10% dintre transplanturile efectuate în lume se fac cu celule stem recoltate direct din măduvă osoasă.
Ziua Mondială a Donatorilor de Celule Stem Hematopoietice: 15 – 17 septembrie |
© Copyright 2025 NewsMed - Toate drepturile rezervate.