1) Denumirea,compoziția și clasa de medicamente de unde face parte
BeneFIX este un medicament antihemoragic utilizat în practica medicală în tratamentul hemofiliei B. BeneFIX 250 UI are ca și substanța activă Nonacog alfa, 250 UI, care conține 415 aminoacizi ordonaţi în structură monocatenară. Factorul de coagulare IX recombinant este o proteină secretată de celule de origine mamiferă, modificate genetic, provenite dintr-o linie celulară obţinută din ovar de hamster chinezesc.
2) Indicații și contraindicații
Indicații:
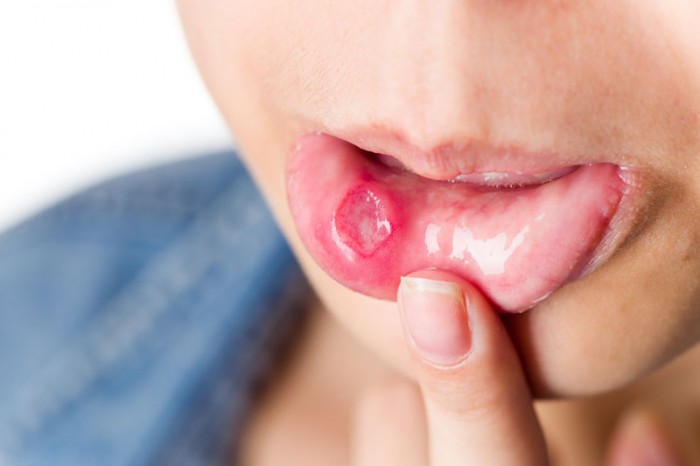
- tratamentul şi profilaxia hemoragiilor la pacienții cu hemofilie B: este o boală ereditară cu transmitere gonozomal recesivă, caracterizată prin deficitul cantitativ sau calitativ al factorului IX al coagulării. Hemofilia B reprezintă 15-20% din hemofilii, iar incidența sa este de 1 la 30.000 nașteri de sex masculin. Manifestările clinice ale bolii sunt variabile în funcție de severitatea bolii (care este dată de importanța deficitului în factor IX, acestea putând fi: ușoare, medii sau severe). Hemoragiile debutează rar la naștere, în formele severe debutează în general, în momentul când copilul se mobilizează, iar în formele moderate debutul este tardiv, la adolescenți.
- Sindromul hemoragic se manifestă prin: hemoragii exteriorizate (hematemeză, melenă, rectoragii, epistaxis, hematurie, hemoragii post-traumatice) sau hemoragii neexteriorizate (hemartroze- sunt foarte frecvente și apar la circa 70% dintre pacienți; artropatia hemofilică; hematoame- care reprezintă aproximativ 30% din manifestările hemoragice, a căror localizare este subcutanat, intraosos sau intramuscular; hemoragii ale sistemului nervos central). Investigațiile paraclinice sunt: teste de orientare (alungirea timpului de coagulare, timpul de sângerare, numărul trombocitelor, timpul Quick, fibrinogenul sunt normale), teste de confirmare (măsurarea concentrației plasmatice de factor IX), teste complementare (grup de sânge și Rh, serologie virală- virusul imunodeficienței umane, virusul hepatitei B și C).
Contraindicații:
- hipersensibilitate la Nonacog alfa sau la oricare dintre excipienții utilizați (pentru pulbere: zahăr, L-histidină, glicina si polisorbat 80; pentru solvent: solutie de clorură de sodiu);
- antecedente cunoscute de reacţii alergice la proteine de hamster.
3) Reacții adverse
- cefalee (dureri de cap);
- tuse productivă;
- febră;
- amețeli;
- disgeuzie (reprezintă o modificare a gustului alimentelor);
- flebită (este inflamația peretelui venos manifestată clinic prin durere, umflături și iritație);
- hiperemie facială (înroșirea feței);
- bufeuri;
- senzaţie de căldură;
- varsături;
- greață;
- erupție cutanată tranzitorie;
- dureri toracice;
- modificări la nivelul locului de injectare (eritem, durere, prurit,disconfort, celulită);
- somnolență;
- migrene;
- tremor;
- afectarea vederii (scotoame, vedere încețoșată);
- tahicardie;
- hipotensiune arterială;
- infarct renal;
- apariția reacţiilor adverse de tip alergic: urticarie simplă sau generalizată, constricţie toracică, wheezing, hipotensiune arterială, anafilaxie si/sau soc anafilactic. Dacă apar simptome de hipersensibilitate, pacienţii trebuie sfătuiţi să întrerupă imediat utilizarea medicamentului şi să contacteze medicul. În caz de şoc anafilactic trebuie instituit tratamentul medical standard pentru șoc;
- bolnavii cu hemofilie B pot dezvolta anticorpi de neutralizare (inhibitori) ai factorului IX;
4) Interacțiuni și atenționări speciale
Complicații tromboembolice
- Deși BeneFIX conţine numai factor IX , este cunoscut faptul că există un risc de tromboză şi coagulare intravasculară diseminată.
- Din cauza riscului potențial de complicații trombotice la medicamentele care conțin factor IX, trebuie inițiată supravegherea clinică pentru depistarea semnelor precoce de coagulopatie trombotică și coagulopatie de consum, însoțită de investigații paraclinice adecvate, la administrarea acestui produs la pacienți cu afectare hepatică, la pacienți în context post-operator, la nou-născuți sau la pacienți cu risc de fenomene trombotice sau coagulare intravasculară diseminată.
- S-au raportat complicații trombotice, incluzând sindromul de venă cavă superioară care poate pune viaţa în pericol la nou-născuţii în stare critică, cărora li s-a administrat perfuzie continuă cu BeneFIX printr-un cateter venos central;
- Beneficiul tratamentului cu BeneFIX în aceste situații trebuie evaluat comparativ cu riscul acestor complicații.
Anticorpi de neutralizare (inhibitori) ai factorului IX
- apariţia inhibitorilor este un eveniment mai puţin frecvent la pacienţii trataţi anterior cu medicamente care conţin factor IX;
- pacienţii trataţi cu BeneFIX trebuie atent monitorizaţi pentru a depista apariţia inhibitorilor de factor IX;
Complicații cardiovasculare
- La pacienții cu factori existenți de risc cardiovascular (fumat, obezitate, sedentarism, hipertensiune arterială, dislipidemii sau hipercolesterolemie, diabetul zaharat), tratamentul de substituție cu BeneFIX poate determina creșterea riscului cardiovascular.
Sindromul nefrotic
- S-a constat apariţia sindromului nefrotic ca urmare a încercării de inducere a toleranţei imune la pacienţii cu hemofilie B care prezentau inhibitori ai factorului IX şi antecedente de reacţii alergice.
- Siguranţa şi eficacitatea utilizării BeneFIX pentru inducerea toleranţei imune nu au fost stabilite.
Sarcină și alăptare
- Utilizaţi BeneFIX 250 UI numai după ce discutaţi cu medicul dumneavoastră (medicul specialist de hematologie sau medicul de familie) beneficiul terapeutic pentru dumneavoastră şi riscul potenţial pentru făt. Nu se cunoaşte riscul potenţial la om. Prin urmare, administrarea factorului IX recombinat trebuie utilizat în timpul sarcinii şi alăptării numai dacă este absolut necesar.
Conducerea vehiculelor şi folosirea de utilaje
- BeneFIX are o influenţă nesemnificativă sau nu influenţează în niciun fel capacitatea de a conduce vehicule şi de a folosi utilaje.
5) Doze și mod de administrare
| BeneFIX 250 UI, pulbere și solvent pentru soluție injectabilă | Fiecare flacon conține nominal Nonacog alfa 250 UI. După reconstituire, cu 5 ml de soluție de clorură de sodiu, fiecare ml de soluție injectabilă conține Nonacog alfa aproximativ 50 UI. |
| BeneFIX 500 UI, pulbere și solvent pentru soluție injectabilă | Fiecare flacon conține nominal Nonacog alfa 500 UI. După reconstituire, cu 5 ml de soluție de clorură de sodiu, fiecare ml de soluție injectabilă conține Nonacog alfa aproximativ 100 UI. |
| BeneFIX 1000 UI, pulbere și solvent pentru soluție injectabilă | Fiecare flacon conține nominal Nonacog alfa 1000 UI. După reconstituire, cu 5 ml de soluție de clorură de sodiu, fiecare ml de soluție injectabilă conține Nonacog alfa aproximativ 200 UI. |
| BeneFIX 2000 UI, pulbere și solvent pentru soluție injectabilă | Fiecare flacon conține nominal Nonacog alfa 2000 UI. După reconstituire, cu 5 ml de soluție de clorură de sodiu, fiecare ml de soluție injectabilă conține Nonacog alfa aproximativ 400 UI. |
| BeneFIX 3000 UI, pulbere și solvent pentru soluție injectabilă | Fiecare flacon conține nominal Nonacog alfa 3000 UI. După reconstituire, cu 5 ml de soluție de clorură de sodiu, fiecare ml de soluție injectabilă conține Nonacog alfa aproximativ 600 UI. |
Doze
- Tratamentul trebuie efectuat sub supravegherea unui medic specialist hematolog. Doza şi durata tratamentului de substituţie depind de severitatea deficitului de factor IX, de localizarea şi amploarea sângerării şi de starea clinică a pacientului.
- BeneFIX poate fi utilizat la toate grupele de vârstă.
- O unitate internaţională (UI) de activitate a factorului IX este echivalentă cu cantitatea de factor IX dintr-un ml de plasmă umană normală.
- Calcularea dozei necesare de BeneFIX poate fi făcută pe baza faptului că administrarea unei unităţi de activitate a factorului IX pe kg duce la creşterea valorii concentraţiei plasmatice de factor IX circulant, în medie cu 0,8 – 1 UI/dl, la pacienţii cu vârsta mai mare sau egala de 12 ani.
Doza necesară de BeneFIX se va determina cu ajutorul formulei:
| număr de UI de factor IX necesar = Greutatea (în kilograme) x creșterea dorită a concentrației plasmatice de factor IX (măsurată în UI/dL sau %) x inversul multiplicativ al indicelui de recuperare adecvat |
Date de referinţă pentru stabilirea dozelor la adulți în episoadele hemoragice şi în intervenţiile chirurgicale:
|
Gradul hemoragiei/ Tipul intervenției chirurgicale |
Valoarea plasmatică de factor IX necesară (UI /dL) |
Frecvența administrării (ore) / Durata tratamentului (zile) |
|
Hemartroză incipientă, hemoragie la nivelul musculaturii sau sângerări orale |
20-40 |
Injecția se repetă la intervale de 48 ore, până când episoadele hemoragice indicate prin durere se remit sau se obţine vindecarea. |
| Hemartroză, sângerare la nivelul musculaturii sau hematom, mai extinse |
30-60 |
Injecția se repetă la intervale de 24 până la 48 ore, până când durerea şi dizabilitatea acută se remit. |
| Hemoragii care pun viaţa în pericol |
60-100 |
Injecția se repetă la intervale de 8 până la 24 ore, până la eliminarea pericolului. |
| Intervenții chirurgicale minore, incluzând extracţiile dentare |
30-60 |
Injecția se repetă după 24 ore, după cum este necesar până când se obţine vindecarea. |
| Intervenţii chirurgicale majore |
80-100 (preoperator si postoperator) |
Injecția se repetă la intervale de 8–24 ore până la vindecarea adecvată a plăgii, apoi tratamentul se continuă timp de cel puţin 7 zile pentru a menţine activitatea factorului IX la 30% până la 60% (UI/dl) |
Profilaxie
- Pentru profilaxia pe termen lung împotriva hemoragiilor, schemele inițiale de tratament recomandate sunt fie: 40 UI/kg la intervale de 3 până la 4 zile, doza ajustându-se pe baza răspunsului individual.
- La copii și adolescenți există indicații limitate pentru tratamentul cu BeneFIX la pacienții cu vârsta mai mică de 6 ani.
- Doza medie pentru profilaxie este de 64 UI/kg administrată la intervale de 3 până la 7 zile.
- La pacienţii mai tineri, pot fi necesare intervale mai scurte pentru administrarea dozelor sau doze mai mari.
- Trebuie efectuată o monitorizare atentă a activităţii factorului IX plasmatic.
Mod de administrare:
- administrare intravenoasă, după reconstituirea pulberii liofilizate pentru soluţie injectabilă cu soluţie sterilă de clorură de sodiu.
Monitorizarea pe parcusul tratamentului:
- În timpul tratamentului, se recomandă determinarea corespunzătoare a valorilor concentraţiilor plasmatice ale factorului IX, cu rol orientativ în stabilirea dozei care trebuie administrată şi a frecvenţei perfuziilor.
- Răspunsul la administrarea de factor IX variază de la un pacient la altul.
- Doza bazată pe greutatea corporală poate necesita ajustări la pacienţii subponderali şi supraponderali.
- În cazul intervenţiilor chirurgicale majore, în mod deosebit, este indispensabilă monitorizarea cu precizie a tratamentului de substituţie prin intermediul testelor de coagulare (activitatea factorului IX plasmatic).
Recomandări !!
- Dacă v-ați administrat mai mult BeneFIX decât trebuie să luați legatura imediat cu medicul de familie sau medicul specialist hematolog.
- Tratamentul cu BeneFIX trebuie întrerupt sau schimbat numai la indicaţiile medicului specialist. Nu trebuie oprit de pacient sau familia pacientului din cauza faptului că acesta se simpte mai bine.
6) Alte informații
- Acest medicament nu trebuie amestecat cu alte medicamente.
- A nu se lăsa la îndemâna şi vederea copiilor.
- Acest produs este numai pentru utilizare unică.
- A se păstra la temperaturi sub 30°C.
- A nu se congela.
- Soluţia reconstituită nu conţine conservant şi trebuie utilizată imediat sau în decurs de cel mult 3 ore de la reconstituire.
- Flaconul de BeneFIX nedeschis are o perioada de valabilitate de 2 ani.
- Nu utilizaţi BeneFIX după data de expirare, înscrisă pe cutie.