Căutare
Căutare
Toate procedurile
Analiza detaliată
Analiza detaliată
 Nici un alt aspect clinic, oricât de grav ar fi, nu pune medicul într-o situaţie limită, aceea de a scruta imposibilul, aşa cum o face cancerul. Acest flagel al secolului nostru, înregistrează statistic şi absolut o creştere relativă, situându-l pe locul II între cauzele de deces din cele mai multe ţări ale lumii. Eforturile investigatorii şi financiare depuse, munca laborioasă şi imaginaţia cheltuită pentru a găsi noi variante terapeutice nu au avut rezultate spectaculoase. Între cancer şi tratamentul său nu s-a pus încă semnul egalităţii. Dar mai ales faptul că ceea ce se cunoaşte despre cancer este partea vizibilă a icebergului, obligă specialistul la o gândire medicală curajoasă, mobilă, eliberată de şabloane şi prejudecăţi.
Nici un alt aspect clinic, oricât de grav ar fi, nu pune medicul într-o situaţie limită, aceea de a scruta imposibilul, aşa cum o face cancerul. Acest flagel al secolului nostru, înregistrează statistic şi absolut o creştere relativă, situându-l pe locul II între cauzele de deces din cele mai multe ţări ale lumii. Eforturile investigatorii şi financiare depuse, munca laborioasă şi imaginaţia cheltuită pentru a găsi noi variante terapeutice nu au avut rezultate spectaculoase. Între cancer şi tratamentul său nu s-a pus încă semnul egalităţii. Dar mai ales faptul că ceea ce se cunoaşte despre cancer este partea vizibilă a icebergului, obligă specialistul la o gândire medicală curajoasă, mobilă, eliberată de şabloane şi prejudecăţi.
Cancerul ovarian afectează în cea mai mare masură femeile tinere și de vârsta medie, dar poate să apară la orice vârstă, inclusiv la fetițe. În ultimii ani, mulţi cercetători consideră că diagnosticul precoce al cancerului ovarian ar fi posibil dacă populaţia feminină de vârstă cuprinsă între 40 şi 70 ani, ar fi supusă unui screening bianual constând din: examen clinic, ecografie transabdominală şi transvaginală (la cazurile suspecte plus Doppler color) şi determinarea concentraţiilor plasmatice ale antigenului CA – 125. Costul enorm al screeningului, absenţa aparaturii performante (Doppler color) în teritoriu, fac puţin probabilă aplicarea acestui program în România în perioada imediat următoare.
Ceea ce trebuie reţinut astăzi în primul rând este că diagnosticul cert de neoplasm ovarian este mai întâi un diagnostic anatomo – patologic cel mai adesea intraoperator şi apoi clinic. Tocmai de aceea medicilor de specialitate (chirurgi și anatomo – patologi) le revine sarcina de a stabili cu precizie varietatea histologică, macroscopică şi microscopică a tumorilor de ovar pentru orientarea şi evaluarea potenţialului terapeutic ulterior. Aplicarea corectă şi completă a unui tratament nu rezolvă boala decât pentru moment, urmând apoi ca o suită întreagă de controale periodice, cu adoptarea unor noi măsuri terapeutice cum sunt chirurgia de control, tratamentul chimio-radio-terapic reluat sau continuat sub supraveghere să completeze spitalizarea anterioară.
Ovarele sunt o pereche de organe în sistemul de reproducere feminin. Acestea sunt situate în pelvis, câte una pe fiecare parte a uterului (organul cavitar, în formă de pară unde se dezvolta fetusul). Fiecare ovar este de aproximativ de marimea și forma unei migdale. Ovarele produc ovule şi hormoni feminini (substanţe chimice care controlează celulele anumit fel sau funcţia de organe). Ele sunt componente ale sistemul de reproducere feminin, care au rolul de a produce și elibera ovulul matur. Momentul cand ovulul este fertilizat de către un spermatozoid marchează începutul unei noi vieți umane. De la prima menstruație până la menopauza, ovarele eliberează un ovul în fiecare lună. Ele sunt, de asemenea, componente esențiale ale sistemului hormonal sau endocrin al organismului.
Ovarele sunt două structuri de culoare gri – roz, în formă de migdală, fiecare având aproximativ 3 cm în lungime și un centimetru în grosime. Ele sunt situate în pelvis, o regiune a corpului care este delimitată de oasele pelvine, fiind situate fiecare lateral față de uter. Poziția ovarelor este menținută de ligamente puternice și elastice.
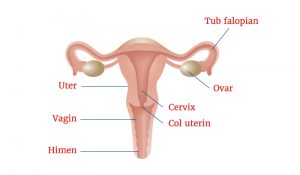
Deasupra fiecărui ovar se deschide infundibulul tubelor Fallopio, prevăzut cu franjuri, care face legatura cu uterul. Deși sunt foarte apropiate, nu există o conexiune directă între ovar și deschiderea tubei. La o femeie matură, ovarele au un aspect relativ neregulat. Motivul acestei neregularități poate fi dedus prin examinarea la microscop a structurii interne. Învelișul ovarului este un strat de celule denumit epiteliu germinativ. Din celule acestui strat delimitant se formează ovulele; mii de ovule imature aflate într-un înveliș sferic, sau folicul, pot fi observate la periferia ovarului.
ușor de observat sunt foliculii ce conțin ovule aflate în diferite stadii de maturație. Pe măsură ce acești foliculi se măresc și după eliberarea ovulului, produc aspectul neregulat caracteristic al suprafeței ovarului. Centrul ovarului este ocupat de un țesut elastic fibros ce funcționează ca un suport pentru stratul extern ce conține foliculii.
Numeroși factori au fost implicați în mecanismul de apariție al cancerului ovarian: factorii de risc, factorii de creștere ai celulelor epiteliale ovariene, factorii hormonali, oncogenele, antioncogenele și anomaliile cromozomiale.
Deşi în prezent, nu s-a reușit definirea cu mare exactitate a populaţiei cu risc crescut, câţiva factori s-au asociat cu creşterea sau descreşterea riscului de boală. Studiile au evidenţiat că: vârsta, rasa, nuliparitatea, infertilitatea, istoricul de cancer endometrial sau cancer de sân, precum şi antecedentele familiale de cancer ovarian s-au însoţit de creşterea riscului de apariţie a cancerului ovarian. Dimpotrivă, paritatea, folosirea contraceptivelor orale, alimentaţia la sân (alăptarea), ligatura tubară, precum şi histerectornia s-au însoţit de scăderea riscului de apariţie a bolii.De asemenea, rolul câtorva factori este încă controversat: vârsta la menarhă, vârsta la menopauză, folosirea tratamentului pentru fertilizare, terapia de substituţie cu estrogeni, folosirea talcului, factorii alimentari, intoleranţa la lactoză, antecedente de parotidită.
Aceasta determină scăderea riscului pentru cancerul ovarian. Riscul de apariţie a cancerului scade cu numărul sarcinilor. În acest sens, unii cercetători au sugerat că, indiferent de efectul primei sarcini duse la termen, acţiunea favorabilă a parităţii asupra riscului de cancer ovarian ar fi amplificată cu ocazia sarcinilor următoare, riscul reducându se cu 14% până la 22% cu fiecare naştere .
Efectele vârstei la prima naştere precum şi a sarcinilor incomplete (avortul, naşterea unui nou născut mort, sarcina ectopică) asupra riscului pentru cancer ovarian, nu au fost încă complet elucidate. Unele studii au arătat existenţa unui efect protector pentru sarcinile incomplete similar sarcinilor duse la termen, alte studii au arătat existenţa unei relaţii invers, proporţionale nesemnificative, iar alte studii au putut demonstra existenţa unei corelaţii între acestea şi riscul pentru cancerul ovarian .
Femeile care au alăptat au un risc scăzut de a face cancer ovarian, faţă de femeile nulipare (care nu au purtat o sarcină) sau de cele multipare (cele care au purtat mai mult de două sarcini), dar care nu au alăptat. Supresia (ovulaţiei) ar putea fi explicaţia posibilă în acest caz. Femeile care au alăptat au prezentat o reducere cu 60% a riscului ameninţător de viaţă comparativ cu nuliparele. Între multipare, riscul ameninţător de viaţă prin cancer ovarian este cu 40 % mai scăzut la cele care au alăptat faţă de cele care nu au alăptat. De asemenea, riscul apariţiei cancerului ovarian pare să scadă cu durata lactaţiei, efectul protector fiind în primele șase luni de lactaţie .
Riscul printre femeile fără antecedente familiale de cancer ovarian este de aproximativ 1,4% (1 din 70 femei), iar pentru cele cu istoric pozitiv este mai mare. Teoretic, infertilitatea endocrină, rezultantă a anovulaţiei ar trebui să diminueze riscul de cancer, iar medicaţia inductoare a ovulaţiei să crească acest risc. Datele sugerează că riscul a fost mai mare printre femeile cu infertilitate de origine ovulatorie decât printre cele cu infertilitate de alte cauze. Femeile infertile care au folosit medicamente pentru creşterea fertilităţii au avut un risc mai crescut comparativ cu cele care nu au folosit aceste medicamente .
Relaţia între vârsta la menarhă şi menopauză şi riscul pentru cancer ovarian este echivocă. Studiile nu au putut stabili o corelaţie semnificativă între riscul de cancer ovarian şi vârsta la menarhă. Datele cu privire la posibila corelaţie între riscul de cancer ovarian şi vârsta la menopauza naturală, sunt la fel de inconsistente. Unele studii au constatat o creştere a riscului pentru cancerul de ovar cu vârsta avansată la menopauză, de aproximativ 1,4 – 4,6 ani, pe când alte studii nu au putut evidenţia această legătură.
Contraceptivele orale combinate (esoprogestativele) reduc riscul de cancer de ovar, iar efectul lor protector este unul din rezultatele care a fost probat în cadrul celor mai consistente studii ale cancerului ovarian. Riscul de cancer ovarian scade cu durata folosirii contraceptivelor orale, în mod evident după 5 ani de folosire, efectul menţinându-se cel puţin 10 – 15 ani după încetarea folosirii acestora. Această protecţie se manifestă la femeile care folosesc contraceptivele orale monofazice cel puţin 3 – 6 luni. Efectul protector oferit de contraceptivele orale a fost observat atât pentru nulipare cât şi pentru multipare si pare să nu varieze cu anumiţi parametri ca: vârstă, vârsta la prima utilizare, paritatea sau indexul ponderal.
De asemenea se pare că folosirea contraceptivelor orale realizează un efect protector foarte accentuat la femeile care au alăptat o perioadă lungă de timp, comparativ cu cele care au alăptat o perioadă scurtă de timp, sau nu au alăptat deloc .
Ligatura tubară (legarea trompelor Fallope) şi histerectormia (extirparea chirurgicală a uterului) s-au însoţit de scăderea riscului de cancer ovarian. Aceste proceduri ar putea determina scăderea contaminării peritoneului şi ovarelor şi, posibil ar putea determina scăderea frecvenţei ovulaţiilor. Deoarece contaminarea peritoneală este puţin probabil să fie cauză de producere a cancerului ovarian, mecanismul cel mai important pare să rămână descreşterea frecvenţei ovulaţiilor.
Asocierea dintre talcul cosmetic şi cancerul ovarian a fost presupusă avându-se în vedere patru lucruri evidente, o relaţie ontogenică între epiteliul ovarian şi mezoteliul peritoneal, relaţia chimică dintre depozitele minerale de talc şi azbest, corelaţia dintre azbest şi mezotelioamele pleurale şi peritoneale şi posibilitatea talcului de a pătrunde în cavitatea peritoneală de a lungul căilor genitale, precum şi faptul că au fost evidenţiate particule de talc în ţesutul ovarian normal şi canceros.
Studiile au arătat existenţa unei corelaţii pozitive între consumul de grăsimi animale, proteine şi numărul total de calorii şi incidenţa cancerului ovarian. Alte studii au constatat creşterea uşoară a riscului asociat creşterii consumului de grăsimi (grăsimi animale, unt, ouă), lapte integral, carne şi proteine şi o scădere a riscului corelată cu un aport crescut de vegetale, cereale, morcovi, zarzavaturi, carbohidraţi, vitamina A (B caroten), vitamina C şi alimente bogate în celuloză. S-a observat prezenţa unui risc crescut pentru cancer ovarian printre femeile cu un consum crescut de lactoză şi o activitate scăzută a transferazei , comparativ cu femeile cu aport scăzut de lactoză şi activitate crescută a transferazei. Nu s-a putut stabili o corelaţie între consumul de alcool şi cafea şi frecvenţa cancerului ovarian .
Sunt multe dovezi că anumite dovezi de cancer au o etiologie genetică, majoritatea cancerelor ovariene epiteliale apar în mod sporadic. Doar 5 % din cancerele ovariene îmbracă forma cancerului familial. Au fost evidenţiate trei tipuri de familii în care agregarea familială a cancerului ovarian a fost evidenţiată prin studii şi anume: familii cu transmisie specifică a cancerului ovarian, familii cu neoplasm de sân şi de ovar şi familii cu neoplasm colorectal non – polipold (sindromul Lynch II).
Susceptibilitatea transmisiei ereditare a cancerului ovarian se pare că se face după un model autosomal dominant. În cazul familiilor cu risc crescut au fost observate un număr crescut de cancere, iar vârsta de debut a bolii a fost mult mai timpurie decât în cazul populaţiei generale. Identificarea genei BRCA – 1 care este legată de prezenţa cancerului de sân familial a fost cercetată şi evidenţiată şi în cazul cancerelor familiale de sân – ovar. Rezultatele câtorva studii caz susţin existenţa asocierii istoricului familial cu neoplasmul ovarian.
Mai multe studii au aratat ca frecvența ovulației este asociată cu creșterea riscului pentru dezvoltarea cancerului ovarian. Ovulația este însoțită de lezarea suprafeței epiteliului ovarian. Acest epiteliu trebuie să prolifereze pentru a vindeca leziunea asociată ovulației și, prin urmare, ovulația este însotita de producerea unor factori de creștere (TGF – α, factor de creștere transformant și IL – 6, interleukina 6) care intensifică creșterea și / sau diferențierea celulelor epiteliale ovariene. Când celulele epiteliului de suprafață se divid, ele se comporta ca și celulele „stem”, mai degrabă generative decât regenerative. Probabil, proliferarea repetitivă a celulelor epiteliului ovarian asociată cu ovulația contribuie la dezvoltarea cancerului ovarian prin creșterea riscului unui accident genetic (eroare în replicarea ADN) care ar putea contribui la activarea unei oncogene sau la inactivarea unei gene supresor.
Factorii de creștere implicați în etiologia cancerului ovarian ar fi: factorul de creștere β-transformant (TGF – β); factorul de creștere epidermal (EGF); factorul de necroză tumorală-α (TNF – α); interleukina-1 (IL – 1); factorul de stimulare a coloniilor de macrofage / monocite (M – CSF); interleukina-6 (IL – 6); factorul de creștere fibroblastică (FGT); substanța inhibitorie mulleriană (MIS). Unii dintre acești factori de creștere au rol stimulator asupra celulelor epiteliale ovariene normale (EGF, FGF, citokinele, IL – 1, IL – 6), alții au rol inhibitor asupra creșterii celulelor epiteliale ovariene (TGF – α, TGF – β) – rol care este anulat sau depășit, alții sunt produși chiar de celulele neoplazice apărute, având rol în intensificarea creșterii celulelor tumorale (M – CSF, GM – CSF, IL – 1, TNF – α, IL – 6). Transducția semnalului la nivel celular pentru factorii de creștere este realizată prin tirozin – proteinkinaze și serin – treonin – proteinkinaze.
Există cinci clase majore de hormoni steroizi: androgeni, estrogeni, progesteron, glucocorticoizi, mineralocorticoizi. Acești hormoni acționează prin legarea lor de receptorul intracelular de înaltă afinitate și specificitate pentru ei de la nivelul celulelor epiteliului de suprafață al ovarului normal, dar și patologic (cancer ovarian). Argumentul important al rolului hormonilor steroizi în apariția cancerului ovarian este legat de faptul că tumorile ovariene prezintă trasături histologice similare cu ale epiteliului trompei uterine (tumorile seroase), cu ale endometrului (tumorile endometrioide) și ale endocervixului (tumorile mucinoase). Deoarece aceste țesuturi răspund în mod normal la estrogeni a fost studiat mai mult rolul acestora în cancerul ovarian.
Hormonii peptidici sunt reprezentați de hormonii pituitari, hormonul luteinizant (LH), hormonul stimulativ folicular (FSH), hormonul gonadotrofinic corionic (HCG), aceștia fiind crescuți un număr de ani după instalarea menopauzei. Celulele epiteliului ovarian de suprafață normal sunt stimulate în ceea ce privește creșterea în vitro de LH, FSH, HCG. Dacă aceste molecule sunt mitogene pentru epiteliul de suprafață ovarian transformat neoplazic, ele pot avea impact indirect în inițierea sau progresia cancerului ovarian.
În cancerul ovarian a fost descrisă exprimarea aberantă a unor oncogene: HER-2/neu, ras, myc, fms, jun, myb. Acestea sunt situate diferit în celula ovariană și au rol biologic diferit. Astfel, HER-2/neu și fms codifică moleculele receptorului transmembranar implicate în legarea ligantului, ras sunt proteine la nivelul membranei interne implicate în transducția semnalului, iar myc, myb, jun sunt proteine reglatoare ale transcripției nucleare.
Prin urmare, oncogenele sunt proteine celulare diverse, cu roluri fiziologice diferite în procesele de creștere și diferențiere celulară. Aceste activitați sunt perturbate prin mutație sau supraexpresie, rezultând fenotipuri transformate.
Gena HER-2/neu a suscitat mai multă atenție. Epiteliul ovarian normal prezintă o exprimare scăzută sau moderată de HER-2/neu. Ea este supraexprimată în cancerul mamar (în 30% din cazuri), supraexpresia fiind corelată cu un prognostic sever. Aceeași oncogenă poate fi utilizată ca marker în cancerul ovarian. Supraexpresia ei poate fi avantajoasă pentru celulele tumorale prin creșterea rezistenței acestora la citotoxicitate (la acțiunea TNF sau a celulelor LAK-celule killer activate de linfokine). Altă oncogena supraexprimată în cancerul ovarian este c-fms care codifică un receptor pentru factorul de creștere (receptor pentru M – CSF).
O altă leziune genetică implicată în geneza și dezvoltarea cancerului ovarian este pierderea funcției normale a genei p53. Această genă, de pe cromozomul 17p este o gena supresor tumorală. Produsul genei p53 este o fosfoproteină nucleară care se exprima în celulele normale jucând un rol în reglarea creșterii și diviziunii celulare. Mutația, supraexprimarea sau deleția acesteia este adesea asociată cu fenotip malign (mutația genei este echivalată cu inhibarea activității ei, ceea ce determină activitate proliferativă anormală).
Un alt supresor genic tumoral, locusul retinoblastomului (RB-locus), care poate juca rol în dezvoltarea cancerului ovarian, constatându-se o frecvență semnificativ crescută a deleției RB în cazul cancerului ovarian.
De asemenea, supraexpresia genei BRCA-1 de pe cromozomul 17q este implicată în sinteza unor receptori specifici pentru anumiți factori de creștere celulară. Determinarea ei constituie un marker pentru evoluția tumorală și este prezentă în peste 80% din cazurile de cancer de sân și ovar.
În cancerul de ovar, cei mai afectați cromozomi au fost 1 și 11 (explică agresivitatea biologică deosebită a acestor cancere), apoi cromozomii 3 și 7.
Tumorile ovariene pot apare din orice celula din componența țesuturilor ovarului sau din celulele precursoare ale acestora. De aici rezultă numărul mare de tipuri histologice (70 tipuri) de tumori ovariene.
1) Tumori seroase
2) Tumori mucinoase
3) Tumori endometrioide
4) Tumori de celule clare (mezonefroide)
5) Tumori Brenner: benigne; la limita malignității; maligne.
6) Tumori mixte epiteliale
7) Carcinoame nediferentiate
8) Tumori epiteliale neclasificabile
1) Tumori cu celule de granuloasă și stromale: tecom; fibrom.
2) Androblastoame: tumori cu celule Sertoli și Leydig
3) Gonadoblastom: pur; asociat cu disgerminom sau alte forme de tumoare cu celule germinale.
4) Neclasificabile
Din punct de vedere histogenetic, aceste categorii de tumori își au originea în: epiteliul de înveliș (epiteliu germinativ); celulele germinale; incluzii embrionare; celulele cordoanelor sexuale și stromale.
Cel mai utilizat este sistemul TNM de stadializare în care T (descrie extensia tumorii primare), N (descrie numărul şi sediul ganglionilor regionali ce pot fi invadaţi malign), iar M (se referă la leziunile secundare, metastazele la distanţă, în alte organe sau ţesuturi faţă de sediul tumorii primare). În funcţie de categoriile T, N, M descrise mai sus se pot stadializa majoritatea cancerelor în următoarele stadii: 0, I, II, III sau IV. Pentru aprecierea categoriilor TNM se utilizează o serie de metode diagnostice specifice fiecărui tip de cancer (biopsii cu examen anatomo – patologic, investigaţii imagistice şi de laborator). Cancerul ovarian se stadializează prin laparotomie exploratorie care permite evaluarea la distanță a bolii neoplazice cu punct de plecare ovarian.
Tx – Tumora primara nu a putut fi stabilită;
To – Nu se evidențiază tumora primară;
Diagnosticul precoce al tumorilor de ovar se confruntă cu trei dificultăţi majore și anume:
Pentru identificarea unei tumori ovariene incipiente în mod ideal ar trebui să existe metode simple care să demaşte markerii procesului malign în fazele incipiente, preclinice ale acestuia. Identificarea unui antigen specific tumoral, eventual numai pentru neoplaziile genitale sau cu altă localizare (de exemplu, ovarul) care ar putea eventual avea şi valoare predictivă asupra tipului histologic şi agresivităţii tumorale ar permite tratamente eficace cu vindecări integrale, chiar cu menţinerea în stare funcţională a ovarului contralateral neafectat .
Tabloul clinic în cancerul de ovar este total nespecific și de obicei descoperit întâmplător în urma intervenției pentru ablația unei tumori ovariene aparent benigne, ca o „surpriză intraoperatorie”. Simptomatologia în cancerul precoce de ovar este needificatoare. În stadiile avansate, aceasta poate atrage atenția prin anumite simptome și semne. Se consideră totuși ca și în aceste stadii, simptoamele și semnele majore pot lipsi (75% din cazuri). Cele șapte simptome care au fost găsite asociate cu cancerul de ovar sunt:
În faza iniţială, tabloul clinic poate fi dominat de o simptomatologie digestivă necaracteristică, constând din greţuri, meteorism, disconfort abdominal, adesea ignorate de paciente. Dezvoltarea tumorii poate determina fenomene compresive pe organele învecinate, clinic exprimându-se prin constipaţie, micţiuni frecvente, compresiune pelvină. Evoluţia tumorii poate determina apariţia unei complicaţii cum ar fi: torsiunea, hemoragia sau ruptura, care se însoţesc de apariţia unei dureri abdominale acute şi instalarea abdomenului acut chirurgical. Apariţia ascitei şi / sau a metastazelor tumorale determină creşterea de volum a abdomenului, fenomen care apare doar în stadii avansate ale bolii. Uneori primul semn ai bolii este reprezentat de evidenţierea unei tumori asimptomatice la tuşeul vaginal, tuşeul rectal sau la palparea abdomenului. Neregularităţile menstruale se pot asocia uneori cu prezenţa cancerului ovarian.
În diagnosticul cancerului de ovar, un aport deosebit îl are imagistica și anume:
→ Ecografia convențională transabdominală – permite un diagnostic precoce.
→ Ecografia endovaginală – permite un diagnostic mai precoce și mai precis.
→ Ecografia tridimensională – este metoda cea mai performantă, pentru că măsoară în special volumul tumorii, localizează topografic tumora în raport cu celelalte structuri din vecinatate.
→ Examenul Dopplerul color – permit și ele un diagnostic cât mai precoce și mai precis în asociere cu ecografia convențională.
În privința tumorilor de ovar, în prezent ecografia a devenit explorarea complementară obligatoriă, datorită accesibilității tot mai largi, prețului redus, avantajele tehnice recente (ecografia tridimensională, examenul Doppler color). Criteriile care constituie suspiciunea de malignitate în cazul cancerului de ovar sunt: formațiuni mai mari de 50 mm; ecostructură solidă sau mixtă cu predominanță solidă; perete neregulat și gros; septuri groase; ascită; metastaze; vârsta > 40 ani (4/5 din cancerele de ovar sunt găsite la femei peste 40 ani); în perimenopauza, creșterea de volum a unui ovar la supraveghere ecografică sistematică.
→ Punctia fundului de sac a lui Douglas – este pozitivă în cancerul de ovar avansat.
→ CT (tomografia computerizată) și RMN (rezonanța magnetică nucleară) – oferă date cât mai exacte asupra extensivității cancerului de ovar. CT-ul vizualizează mai bine calcificările, densitățile groase și vascularizația prin injectarea unei substanțe iodate de contrast bine tolerată, pe când RMN-ul nu vizualizează calcificările, dar permite o perfectă delimitare anatomică. De asemenea, CT-ul poate evidenția noduli tumorali hepatici și pulmonari, mase tumorale abdominale și pelvine, invazia ganglionilor retroperitoneali, leziuni secundare cerebrale, dar și aceasta are limitele ei, neputând detecta mase tumorale sub 2 cm diametru.
→ Limfangiografia – poate fi folosită pentru evaluarea pacientelor cu cancer ovarian, evidențiind prinderea ganglionilor limfatici (pelvini, paraaortici, aortici).
→ Radiografia abdominală pe gol, irigografia, urografia, radiografia pulmonară – pot da informații asupra relațiilor de vecinătate ale tumorii ovariene, gradul ei de extensie loco – regională sau mai ales, evidențierea metastazelor.
→ Pelviscopia – este metoda endoscopică ce are mare valoare în cazurile tumorile de ovar, mai ales la femeile tinere. Ea este avantajoasa pentru depistarea precoce a cancerului de ovar, fiind contraindicată în stadiile avansate. Are valoare deosebită în cazul tumorilor benigne, în tumorile border – line, la femeile tinere sau la grupele de femei cu mare risc.
→ Chiuretajul uterin – are aceleași indicații ca și histeroscopia, dar este o manevră oarbă. În absența histeroscopiei este util, atât în scop diagnostic cât și în scop terapeutic (hemostatic).
→ Laparoscopia – nu constituie un procedeu încurajator în diagnosticul cancerului ovarian. Deși ea poate diferenția ocazional mioame uterine sau endometrioze de un cancer ovarian, aceste cazuri sunt rare. Biopsia laparoscopică sau puncția aspirativă a unei mase ovariene intacte poate răspândi celule maligne în cavitatea peritoneală, iar aspirația fluidului chistic pentru examenul citologic nu constituie o metoda de diagnostic în cancerul ovarian. Peritoneoscopia este utilizata la pacientele “second-look” în cancerul ovarian la pacientele la care s-a obținut remisiune clinică cu ajutorul chimioterapiei. Se poate afirma astfel că, laparoscopia pozitivă (cu biopsie pozitivă) este concludentă, în timp ce laparoscopia negativă trebuie să fie urmată de o laparatomie exploratorie.
Aceștia sunt antigene aflate fie pe suprafața membranei celulare, fie în interiorul celulei tumorale, fie în fluidele organismului. Markerii tumorali antigenici utilizați în cancerul de ovar sunt:
 a) CA 125
a) CA 125 Acesta este un antigen de suprafața derivat din tumorile epiteliale canceroase seroase și este absent în cele mucinoase. El este întâlnit la valori crescute la peste 80% din plasma pacientelor cu cancere de ovar non – mucinoase, putând fi folosit în explorarea cancerului ovarian. Pentru creșterea contribuției acestuia la acuratețea diagnosticului și monitorizarea terapeutică se recomandă asocierea sa cu ecografia transabdominală și transvaginală.
Valorile normale pentru CA 125 sunt sub 35 U/ml. Creșteri fiziologice pot apărea în cursul menstruației și la femeile însărcinate. Valoarea markerului CA 125 este crescută în stadii avansate de evoluție a bolii (stadii II, III, IV). El este mai puțin util pentru diagnostic, dar este de mare ajutor în urmărirea evoluției bolii. Valorile mari ale antigenului CA 125 se asociază cu invazia peritoneala (ascita neoplazică), cu adenocarcinomul papilar seros și cu recidivele locale.
Răspunsul bun la chimioterapie se asociază cu valori normale ale lui CA 125, ceea ce înseamnă stabilizarea bolii. Lipsa unui răspuns eficient la chimioterapie se asociază cu valori crescute ale antigenului CA 125, ceea ce impune schimbarea tratamentului.
Pentru creșterea valorii markerului tumoral CA 125 mai ales în depistarea precoce a cancerului ovarian se impune asocierea determinării sale cu examenul ginecologic și ecografia pelvină dupa un anume algoritm: după 35 ani la trei ani; după 40 ani la doi ani sau dupa alți autori la doi ani, după vârsta de 25 de ani.
Acesta este un marker biologic pentru detectarea cancerului ovarian, cu o foarte scăzută expresie în țesutul ovarian normal. Corespunzător expresiei la nivel celular, nivele crescute de HE 4 au fost detectate în serul pacientelor cu cancer ovarian. HE 4 are o sensibilitate de 70 – 80 % și o specificitate de 95 – 96 % în diagnosticul cancerului ovarian.
Determinările repetate ale HE 4 și estimarea creșterii procentuale sunt utile în monitorizarea evoluției bolii și apariția recurențelor la pacientele cu cancer ovarian epitelial. Acest test nu trebuie folosit ca un test de screening și nu se recomandă în monitorizarea pacientelor cu alte tipuri de tumori ovariene (mucinoase, cu celule germinale) – în care nu apar creșteri ale HE 4.
Studiile demonstrează că HE 4 este mai sensibil decât CA 125, combinația dintre HE 4 și CA 125 fiind mai sensibilă decât fiecare marker singur, iar pentru stadiul I, HE 4 singur este cel mai sensibil marker.
Acesta este un polipeptid cu proprietăți antigenice specifice produs în placenta umană, în tumorile maligne umane și în fluidele pacienților cu cancer. Este folosit ca marker mai ales pentru monitorizarea evoluției pacienților cu cancer mamar sau ovarian în cursul tratamentului. Specificitatea TPA pentru diagnostic este medie – slabă. Poate fi folosit și ca marker unic în cazurile în care nu sunt disponibili alți markeri specifici, însă în combinație cu alți markeri tumorali specificitatea testării crește semnificativ. Spre deosebire de ceilalți markeri a căror concentrație se corelează cu masa tumorală, TPA indică activitatea actuală a tumorii, de aceea este numit și „antigen de proliferare”. TPA este sintetizat în faza S a ciclului celular, iar concentrația TPA se corelează cu proliferarea tisulară.
Valorile crescute se asociază cu procesele proliferative care pot fi de natură benignă sau malignă. Astfel, TPA indică mai rapid și mai precis schimbările survenite în procesul malign, fiind util atât în monitorizarea terapiei cât și în depistarea recurențelor. Poate fi identificat în urină, salivă, lichid de lavaj bronhoalveolar sau de ascită, aceste determinări fiind de multe ori mai valoroase decât cele din ser. TPA crește frecvent în inflamații, infecții respiratorii, diabet zaharat, hepatită cronică, ciroză hepatică, pancreatită, insuficiență renală.
Hemoleucograma: este un test screening de bază, fiind unul din cele mai frecvent cerute teste de laborator, reprezentând adesea primul pas în stabilirea statusului hematologic și diagnosticul diverselor afecțiuni hematologice și nehematologice. Cuantificarea parametrilor hematologici asociată uneori cu examinarea frotiului de sânge aduce informații prețioase, orientând în continuare spre efectuarea altor teste specifice. Hemograma completă este o analiză care măsoară următoarele:
Uneori se recomandă și testarea genetică pentru a se vedea dacă persoana prezintă o mutație specifică a genelor BRCA 1 sau BRCA 2 la care s-a demonstrat o legătură cu cancerul ovarian și cu cel mamar. Sindromul cancerului ereditar de san și de ovar (HBOC = Hereditary Breast – Ovarian Cancer Syndrome) are la bază o predispoziție genetică de a dezvolta cancer și se caracterizează prin:
Deși cele mai multe cazuri de cancer mamar și ovarian nu sunt moștenite, aproximativ 3 – 5% dintre cancerele de sân și 10% dintre cancerele de ovar sunt încadrate în HBOC. Numeroasele studii efectuate au arătat că mutațiile genelor BRCA 1 și BRCA 2 care afectează linia germinală sunt responsabile de marea majoritate a cancerelor ereditare de sân și ovar.
La femeile cu mutații BRCA 1 sau BRCA 2, riscul de cancer ovarian este de 39 – 46% și, respectiv, de 12 – 20%. Cancerul ovarian prezintă un fenotip histologic distinct la aceasta categorie de paciente, înregistrându-se în principal tumori seroase sau endometrioide de grad înalt.
În afara cancerului ereditar de san si ovar, mutațiile BRCA 1 și BRCA 2 pot fi asociate și cu alte forme de cancer. Astfel, s-a estimat că riscul de cancer de prostată este de trei ori mai mare la bărbații purtători de mutații BRCA 1 în comparație cu populația generală. Mai mult, cazuri de cancer de pancreas, prostată, esofag, laringe, stomac, colon, vezică biliară, duct biliar, melanom au fost raportate în familiile cu mutații BRCA 2 ce predispun la cancer.
Testarea genetică este importantă în practica clinică pentru identificarea persoanelor care prezintă un risc semnificativ de cancer de sân sau de ovar și aplicarea strategiilor adecvate de screening și preventie. Se recomandă testarea genetică la persoanele cu un risc ≥ 20 – 25% de a avea o predispoziție moștenită pentru cancerul mamar sau ovarian:
|
Un rezultat negativ este definit prin absența mutațiilor liniei germinale în genele BRCA 1 și BRCA 2. În cazul unei persoane afectate acesta indică că procesul neoplazic a apărut spontan și nu ca urmare a mutațiilor pe linie germinală. În cazul unei persoane cu risc crescut, un rezultat negativ poate avea urmatoarele semnificații: nu a fost moștenită mutația specifică familiei; este prezentă o mutație BRCA 1 sau BRCA 2 care nu poate fi detectată sau nu a fost încă identificată; în acest caz predispoziția persoanei în cauza pentru cancerul mamar sau ovarian ereditar rămâne necunoscută; nu există o predispoziție familială pentru cancerul mamar sau ovarian ereditar. Dacă nu este detectată o mutație la persoanele cu risc crescut, probabilitatea de apariție a cancerului de sân, respectiv, de ovar este comparabilă cu cea din populația generală.
În cazul unui rezultat pozitiv pentru mutațiile BRCA 1 și BRCA 2 ale liniei germinale la o persoană cu risc crescut, este necesar ca medicul să furnizeze toate informațiile cu privire la opțiunile de monitorizare, screening, chimioprofilaxie sau chirurgie profilactică disponibile; trebuie să se ia obligatoriu în considerare implicațiile psihologice și familiale.
Deși are o valoare limitată în depistarea precoce a tumorilor ovariene,
screening-ul și prevenția cancerului ovarian se recomandă efectuarea periodică (la șase luni) a marker-ului CA 125 în asociere cu ecografia transvaginală la persoanele cu mutații BRCA 1 sau BRCA 2, începând cu vârsta de 30 – 35 ani. Salpingo – ovariectomia (eliminarea chirurgicală a ovarelor și a trompelor uterine) profilactică în jurul vârstei de 40 ani poate reduce riscul de cancer ovarian la această categorie de persoane cu aproximativ 85 – 90%. |
Examenul anatomo – patologic al piesei obținute în urma intervenției chirurgicale este de „căpătâi”. El pune diagnosticul de malignitate, stabilind tipul histologic al tumorii ovariene, sensibilizând astfel medicul în ceea ce privește tipul terapiei pentru care va opta, complicațiile ce pot apărea și un anume rezultat al terapiei sale. Acesta reprezintă defapt, analizarea microscopică a unor fragmente de organe sau ţesuturi. Se recoltează prin biopsie, realizată printr-o intervenţie chirurgicală. Fragmentele sunt prelucrate chimic şi apoi examinate la microscop, obţinându-se astfel examenul anatomo – – patologic.
În afara biopsiei chirurgicale clasice, fragmente de ţesut se mai obţin cu ajutorul unor dispozitive speciale care realizează prelevarea unei mostre de ţesut tumoral din „miezul’’ tumorii – aşa numitele „core – biopsy“ utilizate pentru diagnosticul de certitudine al tumorilor de sân care nu au drept primă indicaţie terapeutică, rezecţia chirurgicală a tumorii. De asemenea mai există puncţia – biopsie aspirativă care se realizează cu ace fine – speciale, iar aspiratul obţinut este utilizat pentru obţinerea unui examen citologic, adică al celulelor (spre deosebire de biopsie prin care se recoltează fragmente de ţesuturi).
Teste imunohistochimice oferă următoarele:
Examenul imunohistochimic este o metodă adjuvantă pentru examenul anatomo – patologic care poate preciza o serie de caracteristici intrinseci ale tumorii (prezenţa unor receptori, a unor anomalii celulare specifice) utilizate pentru individualizarea tratamentelor oncologice (adică, fiecare pacient să primească un anumit tip de tratament, cât mai adecvat tumorii pe care o are, cu toate caracteristicile ei). Prin acest examen se poate stabili mai exact tipul de cancer precum şi modalitatea terapeutică cea mai eficientă.
În anumite cazuri, colorațiile imunohistochimice sunt esențiale pentru a confirma prezența unor antigene fără de care nu se poate preciza un diagnostic exact. În acest caz, vi se va cere acordul prealabil, având în vedere costurile suplimentare pe care le implică. În alte cazuri, anatomo – patologul va preciza un diagnostic, dar va recomanda completarea lui cu teste imunohistochimice. Aceste detalii sunt foarte importante pentru conduita terapeutică ulterioară, putând să facă chiar diferența în succesul tratamentului. Tehnicile imunohistochimice dau adesea informații mult mai prețioase chiar decât alte analize performante, cum este rezonanța magnetică nucleară.
Cancerul de ovar este un boală gravă, cu evoluție rapidă chiar sub tratamentul complex, rata de supraviețuire fiind de 15 – 35%. Gravitatea și evolutia sunt dependente de mai mulți factori:
Evoluția poate fi: rapidă spre complicații și metastaze, cu prognostic sumbru (în special, adenocarcinoamele seroase și carcinomul nediferențiat) sau lentă, cu prognostic bun (border – line tumors) sau LMP (low malignant potential).
Evoluția spre complicații și metastaze se realizează pe următoarele căi: calea peritoneală, calea limfatică și calea sanguină.
Aceasta este principala cale de diseminare în cazul tumorilor epiteliale. Acest fapt s-ar explica prin tropismul pentru peritoneu pe care îl prezinta celulele maligne desprinse din tumorile epiteliale ovariene, probabil prin originea embriologică comună.
Diseminările prind peritoneul parietal, mai rar pe cel visceral, grefarea celulelor descuamate făcându-se de preferință în locurile declive: fundul de sac Douglas, peritoneul pelvin (cel mai frecvent), spațiile parieto – colice și peritoneul parietal, până pe fața inferioară a diafragmului drept, unde se realizează tumorile secundare (metastazele). Însămânțările de la nivelul marelui epiplon converg spre realizarea unei adevarate platoșe epiploice care, în final, produce ocluziile intestinale. Vecinătatea apropiată de pelvis a marelui epiplon (rect, ileon terminal în dreapta, colon sigmoid în stânga) face ca și peritoneul organelor să fie sediul unor diseminări secundare: extensia la ovarul opus (6 – 13% din pacientele cu boala în stadiul I), uter și trompe uterine (5% din bolnave în stadiul I). În stadiile mai avansate, uterul este invadat la 25% din paciente. Poate fi interesată, de asemenea, suprafața vezicii urinare, rectosigmoidul sau peritoneul pelvin.
Diseminarea prin implantare duce la carcinomatoză peritoneală, responsabilă în mare măsură de drama abdominală a cancerului ovarian – sindromul ocluziv, datorat fie fenomenelor obstructive date de procesele tumorale, fie procesului de compresiune. Cel mai grav este infiltrarea mezenterului, cu retracția acestuia și cu ocluzii multiple ce nu au soluții terapeutice.
Extensia pe cale limfatică se face pe trei căi și anume:
Limfa peritoneului parietal este drenată prin plexul limfatic subdiafragmatic, mai ales în dreapta; celulele neoplazice se pot fixa aici sau pot trece mai departe pe căile menționate. Celulele neoplazice pot bloca plexul limfatic subdiafragmatic, acesta constituind unul din mecanismele de producere a ascitei neoplazice.
Aceasta este responsabilă de metastazele la distanță de obicei, extraabdominale (pulmonare, pleurale, cerebrale, intrahepatice). Organele ce pot fi sediul metastazelor la distanță sunt în ordinea descrescătoare a frecvenței: ficat, plămân, pleură, rinichi, oase, glande suprarenale, vezica urinară, splina. În general, cancerele ovariene metastazează la distanță relativ târziu și rar, scena principala a dramei și finalul aparținând cavității peritoneale.
Tratamentul în cancerul ovarian este complex, incluzând asocierea mai multor metode terapeutice prin care se urmarește îmbunătățirea duratei de supraviețuire. Intervenția terapeutică se realizează în funcție de stadiul clinic al bolii. Tratamentul cancerului ovarian poate fi: tratament chirurgical, tratament chimioterapic, radioterapia, hormonoterapia și imunoterapia.
Intervenția chirurgicală deține prioritatea asupra celorlalte mijloace terapeutice. O intervenție chirurgicală inițială completă și corectă este crucială pentru tratamentul cancerului ovarian. Succesul terapiei ulterioare este, în mare parte, determinat de actul chirurgical inițial. Exereza chirurgicală se practica în cazul tumorilor ovariene de graniță (border – line) și cancerelor ovariene în stadile I și II. A devenit însă clar că exereza chirurgicală, oricât de largă ar fi, nu creează sentimentul de siguranță oncologică absolută nici măcar pentru stadiul I al bolii. Celulele neoplazice exfoliate în marea cavitate peritoneală pot oricând genera noi tumori. Se considera în prezent că, numai pacientele în stadiile IA și IB cu tumori moderat diferențiate din punct de vedere histologic, nu necesită tratament adjuvant postoperator.
În pofida unor intervenții primare extinse, multe paciente cu cancer ovarian decedează. Plecând de la aceasta observație, s-a propus aplicarea reintervenției de control (second look – examinare amănunțită a abdomenului și pelvisului, urmărindu-se aceeași procedură ca în cazul intervenției chirurgicale primare). Dacă există mase tumorale evidente trebuie biopsiați ganglionii limfatici pelvini și paraaortici. Masa tumorală reziduala trebuie rezecată daca este posibil. Există situatii în care intervenția chirurgicală se restrânge de la început la un act paleativ sau o asemenea atitudine se impune cu ocazia uneia din intervențiile de control.
Aceasta este principală metodă terapeutică adjuvantă actului chirurgical sau utilizată ca tratament inițial în cancerele ovariene avansate. Chimioterapia poate fi aplicată ca și: monoterapie sau polichimioterapie.
Agenții folosiți sunt cu precădere agenții alkilanți (Melfalan, Clorambucil, Ciclofosfamidă, Thiotepa), dar și Carboplatin, Cisplatin, Doxorubicină, Nexametilmelamina, Taxol).
Combinațiile chimioterapice au un răspuns complet între 20 – 90% (îmbunătățirea semnificativă a supraviețuirii). Combinația poate să cuprinda: două citostatice (Ciclofosfamidă, Cisplatin), trei citostatice (Cisplatin, Doxorubicină, Ciclofosfamidă) sau patru citostatice (Hexametilmelamina, Ciclofosfamida, Metrotexat, 5-Fluorouracil).
Ca și concluzie aici, chimioterapia își are locul bine stabilit în tratamentul cancerului ovarian; ea se impune ca tratament adjuvant chiar în stadiul I de boală și devine preponderentă în stadiile avansate.
Aceasta este utilizată ca tratament adjuvant în cancerul de ovar, după citoreducție chirurgicală maximală, pentru tratarea unor tumori inoperabile, care nu răspund la chimioterapie, ca terapie „de salvare” la pacientele cu boală persistentă după tratament primar, chimioterapie și intervenții second – look. Ea poate fi folosită și ca tratament paleativ la pacientele cu mase pelvine sau metastaze (cerebrale, hepatice, osoase). Radioizotopii utilizați sunt: Au196 și P32. Doza și schemele de fracționare a dozei iradiante reprezintă un compromis între dozele tumoricide necesare pentru distrugerea maselor tumorale și pericolul agresivității semnificative asupra țesuturilor normale. Ca și concluzie, radioterapia este o metodă cu reale posibilități în tratamentul cancerului de ovar, dar locul sau în terapia acestuia este după tratamentul chirurgical și citostatic.
Introducerea tratamentului hormonal în terapia cancerului ovarian nu s-a bazat pe prezența de receptori pentru estrogen și progesteron. Cele mai folosite preparate au fost: Megace, Medroxiprogesteron, Tamoxifen. Poate intra în discuție tratamentul și la femei tinere cu stadiul IA și tumori border – line.
Astăzi se ştie că, pe lângă acţiunea antivirală, interferonii pot afecta profund anumite celule şi anumite funcţii ale organismului, incluzând metabolismul, proliferarea celulară, stimularea hormonală, imunitatea şi dezvoltarea tumorală. Aceasta metoda foloseste administrarea de interferon gamma, TNF, IL-2, LAK, vaccin cu Corynebacterium parvum, Melfalan, Levamisol, Polidin. Imunoterapia nespecifică asociata chimioterapiei s-a dovedit activa în cancerul ovarian, dar utilizarea singulară a acesteia este ambiguă.

Cistita , Anomalii ale sanilor , Atrofia vaginală - cauze, diagnostic, tratament Cancerul de col uterin

Dislipidemia , Nefropatia diabetica , Sindromul insulinic autoimun cu hipoglicemie Neuropatia diabetica
© Copyright 2025 NewsMed - Toate drepturile rezervate.